
| A. | 5mol | B. | $\frac{5}{3}$mol | C. | $\frac{5}{6}$mol | D. | $\frac{2}{5}$mol |
分析 n(Br2)=$\frac{80g}{160g/mol}$=0.5mol,该反应中Br元素化合价由+5价、-1价变为0价,所以溴既是氧化产物也是还原产物,且有$\frac{1}{6}$的溴来自于BrO3-,据此计算.
解答 解:n(Br2)=$\frac{80g}{160g/mol}$=0.5mol,该反应中Br元素化合价由+5价、-1价变为0价,所以溴既是氧化产物也是还原产物,且有$\frac{1}{6}$的溴来自于BrO3-,若有80g溴单质生成,转移电子物质的量=0.5mol×2×$\frac{1}{6}$×(5-0)=$\frac{5}{6}$mol,故选C.
点评 本题考查氧化还原反应计算,为高频考点,明确溴中氧化产物和还原产物物质的量之比是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
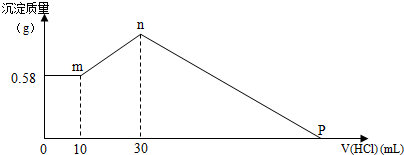
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③ | C. | ①⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
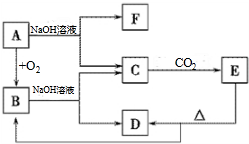
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
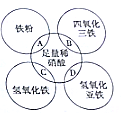 已知稀硝酸是强氧化性酸,还原产物一般为NO,如图两圆相交部分A、B、C、D分别表示两物质间的反应,下列各对应反应的离子方程式书写不正确的是( )
已知稀硝酸是强氧化性酸,还原产物一般为NO,如图两圆相交部分A、B、C、D分别表示两物质间的反应,下列各对应反应的离子方程式书写不正确的是( )| A. | Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 3Fe(OH)2+10H++NO3-═3Fe3++NO↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
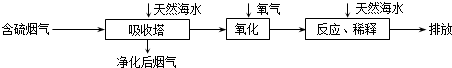

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com