
| A、HD、CaCl2、NaOH、HCl四种物质都属于化合物 |
| B、有单质参加或生成的反应一定属于氧化还原反应 |
| C、金属氧化物不一定是碱性氧化物,酸酐不一定是酸性氧化物 |
| D、金属单质只能做还原剂,非金属单质只能做氧化剂 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y>Z>W |
| B、XW2熔点为-107℃,沸点为12.5℃,说明固态XW2为分子晶体 |
| C、工业上电解熔融YW3可得单质Y |
| D、单质Y、Z、W均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业酒精(含甲醇)兑水配自制白酒饮用 |
| B、用工业石蜡等给瓜子美容 |
| C、制作腊肉常加入亚硝酸盐作增色剂和防腐剂,宜长期食用 |
| D、在食用盐中加入碘酸钾(KIO3)以消除碘缺乏病 |
查看答案和解析>>
科目:高中化学 来源: 题型:
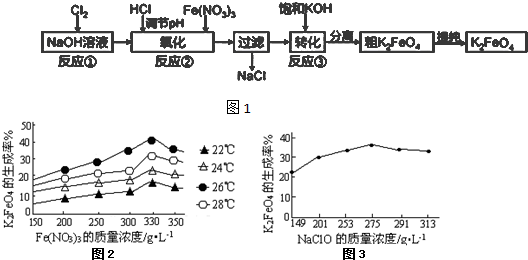
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com