
分析 (1)根据n=$\frac{m}{M}$计算出NH4Cl的物质的量,再由KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8,可计算KCl和K2SO4的物质的量及质量;
(2)依据C=$\frac{n}{V}$计算各物质的物质的量浓度;
(3)计算混合液中钾离子物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算稀释后c(K+)的浓度.
解答 解:(1)428gNH4Cl的物质的量为$\frac{428g}{53.5g/mol}$=8mol,
由KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8,
则n(KCl)=1mol,m(KCl)=1mol×74.5g/mol=74.5g,
n(K2SO4)=4mol,m(K2SO4)=4mol×174g/mol=696g,
答:m(KCl)=74.5g; m(K2SO4)=696g;
(2)C( NH4Cl)=$\frac{n}{V}$=$\frac{8mol}{10L}$=0.8mol/L;
C(K2SO4)=$\frac{n}{V}$=$\frac{4mol}{10L}$=0.4mol/L;
C(KCl)=$\frac{n}{V}$=$\frac{1mol}{10L}$=0.1mol/L;
答:C(KCl)=0.1mol/L; C(K2SO4)=0.4mol/L;C( NH4Cl)=0.8mol/L;
(3)配制的该营养液中钾离子浓度为C(K+)=$\frac{n}{V}$=$\frac{4mol×2+1mol×1}{10L}$=0.9mol/L,
则依据溶液稀释规律得:0.9mol/L×10mL=100mL×C(K+),
解得:c(K+)=0.09 mol/L;
答:C(K+)=0.09 mol/L.
点评 本题考查了物质的量为中心的基本计算,明确质量、物质的量及物质的摩尔质量之间的关系即可解答,难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
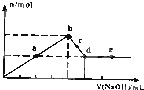 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A. | a、c两点沉淀物成份不相同,d、e两点沉淀物成份相同 | |
| B. | b点溶液的中c(Na+)=c(C1-) | |
| C. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| D. | 在d点,向溶液中加入少量盐酸,沉淀量将减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨、金刚石、足球烯互为同分异构体 | |
| B. | 甲酸(HCOOH)与乙酸(CH3COOH)属于同系物 | |
| C. | 人们发现了118种元素,即共有118种原子 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
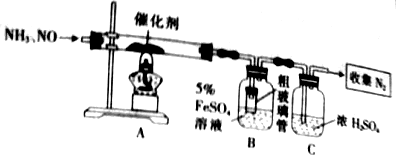
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
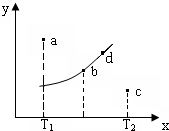 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )| A. | Q<0 | |
| B. | 平衡常数值:b点<d点 | |
| C. | T1温度下若由a点达到平衡,可以采取增大压强的方法 | |
| D. | c点v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中含有的阴离子数等于0.2NA | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com