
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
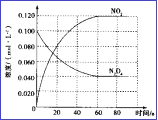
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
【答案】 2858 2CO(g)+4H2(g)=CH3OCH3(g) +H2O(g) △=-204.7 kJmol-1 0.0010mol/(L·s) 299 1.95×10-3
【解析】(1)由H2(g)的燃烧热△H为﹣285.8kJmol﹣1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ。
(2)(i)CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJmol﹣1;(iV)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=﹣24.5kJmol﹣1;依据盖斯定律,由(i)×2+(iV)可以得到由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)=CH3OCH3+H2O(g) △H=﹣204.7kJmol﹣1。
(3)由图可知,在0~60s时段,的浓度由0.100 mol/L减小到0.040 mol/L,减小了0.060 mol/L,所以v(N2O4)= ![]() =0.0010mol/(L·s)。
=0.0010mol/(L·s)。
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,ΔH=反应物的键能总和-生成物的键能总和,则1molHI(g)分子中化学键断裂时需吸收的能量为(+11kJ+436kJ +151kJ)![]() +299kJ。由表中数据可知,在t=40min时,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1
+299kJ。由表中数据可知,在t=40min时,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1![]() 1.95×10-3min-1。
1.95×10-3min-1。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与NaClO2溶液反应来制取少量ClO2,装置如下图所示:
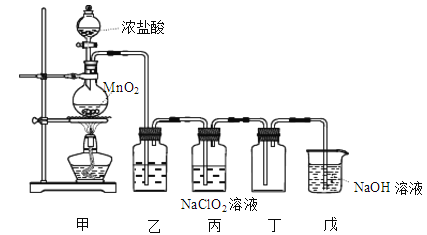
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:①______(用化学方程式表示),②HClO + HCl + 2NaClO2 = 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化ClO2的生成,若无乙装置,则丙装置内产生ClO2的速率明显加快。实验过程中常需通入适量的N2稀释ClO2,其目的是______。写出氯气制漂白液的化学方程式并用双线桥表示电子转移的方向与数目______。
(4)戊装置烧杯中NaOH溶液吸收ClO2后,生成了ClO-、ClO3-,该反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作与说法正确的是( )
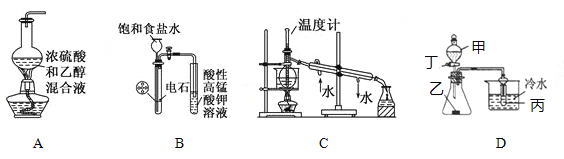
A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关反应的离子方程式书写正确的是
A. Al2O3与过量氨水:Al2O3+2NH3·H2O═2AlO![]() +2NH4++H2O
+2NH4++H2O
B. 钠与水反应:2Na+2H+═2Na++H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO![]() ═HCO
═HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,11.2L O2和22.4L NO混合并充分反应后得到的气体的分子数为NA
B. 常温下0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
C. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D. 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
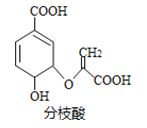
A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com