
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
分析 化学键分为离子键和共价键,离子键为阴、阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键.
解答 解:A.HCl只含有共价键,MgCl2和NH4Cl存在离子键,化学键类型不相同,故A错误;
B.H2O和CO2只含有共价键,Na2O存在离子键,化学键类型不相同,故B错误;
C.NH3、H2O、CO2都为共价化合物,只含有共价键,化学键类型相同,故C正确;
D.CaCl2为离子化合物,含有离子键,NaOH为离子化合物,含有离子键和共价键,H2O为共价化合物,只含有共价键,化学键类型不相同,故D错误.
故选C.
点评 本题考查化学键,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
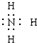 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com