
(8分)(1)3.01×1022个OH-的物质的量为 质量为 ,这些OH-与 mol NH3的质量相等,与 g Na+含有的离子数相同;
⑵将4.6 g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
况下的气体 L,实验后所得溶液中Na+的物质的量为 ;
⑶同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量之比为 原子个数之比 。
科目:高中化学 来源: 题型:
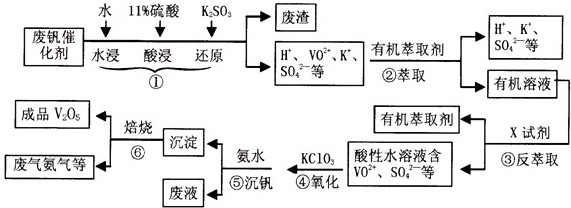
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省中山一中高二下学期第一次段考化学试卷 题型:填空题
(共8分)
(1)(3分)有反应:2NO2 N2O4 △H<0,根据图像判断后填空:
N2O4 △H<0,根据图像判断后填空:
|
 t1 t2 t3 t4 t5 t6 t
t1 t2 t3 t4 t5 t6 t
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省淮南市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题:
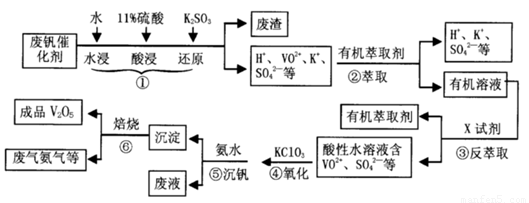
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是
。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
|
pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
|
钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为 。
(6)该工艺流程中,可以循环利用的物质有 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三12月联考化学试卷(解析版) 题型:填空题
(8分)甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇。
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g) 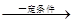 CO(g)+3H2(g)
I。
CO(g)+3H2(g)
I。
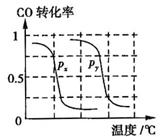
CH4的转化率与温度、压强的关系如图所示。
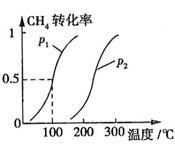
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的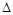 H
0。(填“<”、“>”或“=”)
H
0。(填“<”、“>”或“=”)
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH30H(g)
CH30H(g) 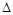 H<0 Ⅱ。
H<0 Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是 (填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充人lmolCO和3 mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中。
|
实验编号 |
T(℃) |
n(CO)/n(H2) |
p(MPa) |
|
l |
150 |
1/3 |
0.1 |
|
2 |
n |
1/3 |
5 |
|
3 |
350 |
m |
5 |
a.上表中剩余的实验条件数据:n= ,m= 。
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强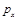 = MPa。
= MPa。
查看答案和解析>>
科目:高中化学 来源:2012届广东省山一高二下学期第一次段考化学试卷 题型:填空题
(共8分)
(1)(3分)有反应:2NO2 N2O4 △H<0,根据图像判断后填空:
N2O4 △H<0,根据图像判断后填空:
|

t1 t2 t3 t4 t5 t6 t
t1至t3采取的措施是_____________;t4至t5采取的措施是______________t6采取的措施是_________________。
(2)(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol www..com
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 。
(3)(2分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。则该反应的化学方程式为________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com