
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)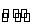 2NH3(g),673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
重铬酸钾 A是橙红色的固体,有强氧化性。①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C;②在C中加入KOH溶液,先生成灰蓝色沉淀D;③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E;④在E中加入H2O2加热则生成黄色溶液F,⑤F用稀硫酸酸化,又变成原来的化合物A的溶液。
已知:氢氧化铬在溶液中存在如下平衡:
Cr3++3OH- Cr(OH)3
Cr(OH)3 H2O+HCrO2
H2O+HCrO2 H2O +H++ CrO2-
H2O +H++ CrO2-
蓝紫色 灰蓝色 绿色
(1)根据上述平衡判断氢氧化铬具有____________(填“碱性”、“酸性”、“两性”)。
(2)写出①的离子方程式______________________________________________;
(3)已知D的溶解度为2.06×10-7g ,则D的溶度积常数为______________。
(4)写出③的离子反应方程式________________________________________
(5)④F溶液中的黄色离子是__________(写化学式);若参加反应的H2O2是5mol,则生成的黄色离子的物质的量为__________________。
(6)金属锡(Sn)是第ⅣA的元素,通过下列方法可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应化学方程式为:__________________________________;
②向①的溶液中再加入过量的FeCl3溶液,发生的反应化学方程式为_________________;
③用已知浓度的A溶液滴定生成的Fe2+。现有金属锡样品wg,经上述各步反应后,用A溶液滴定,A应放在__________(填“酸式”或“碱式”)滴定管中,共用去cmol·L-1的A溶液vmL(锡的相对原子质量用M表示)。求样品中锡的质量分数为_____________(假定杂质不参加反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期律和物质结构的有关知识,以下有关排序错误的是
A、离子半径:S2->Cl->Ca2+ B、原子半径:Ca>S>Cl
C、热稳定性:HCl>H2S>H2Se D、酸性:HClO4<HBrO4<HIO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是_________;
(2)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
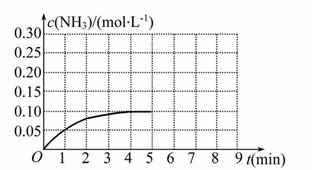
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氯化铁水解的说法错误的是( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50 ℃和20 ℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
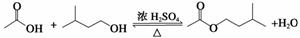
| 相对分 子质量 | 密度/ (g·cm-3) | 沸点/℃ | 水中 溶解性 | |
| 异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
| 乙酸 | 60 | 1.049 2 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
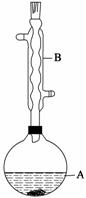
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是__________________________________,
第二次水洗的主要目的是__________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________。
(5)实验中加入少量无水MgSO4的目的是_______________________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
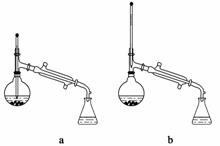
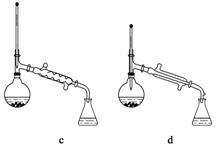
(7)本实验的产率是________(填标号)。
a.30% b.40%
c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏____(填“高”或“低”) ,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
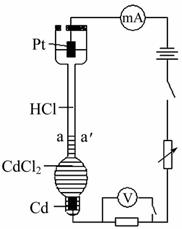 设计如图装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。
设计如图装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。
恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是( )
A.通电时,H+、Cd2+向Pt电极迁移,Cl-向Cd电极迁移
B.装置中总反应的化学方程式为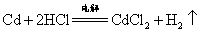
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com