
下列化学用语表示正确的是( )
A.二氧化碳  B.氮原子的轨道表示式:
B.氮原子的轨道表示式:
C.氯离子的最外层电子排布:3s23p6 D.硫离子的结构示意图:
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本 结构如图所示,其中作为电解质的无水LiClKCl混合物受热熔融后,电池即可瞬间输出 电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是 ( )

A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量 | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,________________对反应速率有影响,______________反应速率越快,能表明同一规律的实验还有__________(填实验序号);
(2)实验1、3、4、6、8表明反应物浓度对反应速率产生影响,能表明同一规律的实验还有______________(填实验序号);
(3)本实验中影响反应速率的其他因素还有________,其实验序号是6和________,8和__________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=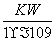 mol/L
mol/L
B.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对Na、Mg、Al的有关性质的叙述正确的是( )
A.还原性:Na>Mg>Al B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
用价层电子对互斥理论预测NH3和BF3的空间构型,结论正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.三角锥形;平面三角形 D.直线形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
2SO3,在混合气体中充入一定量的18O2,足够长时间后,18O原子( )
A.存在于SO2、O2、SO3中 B.只存在于SO2、O2中
C.只存在于O2、SO3中 D.只存在于SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
正极电极反应式为____________ ____ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________________,当线路中转移0.2mol电子时,则被腐蚀铜的质量为 g
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ _____。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
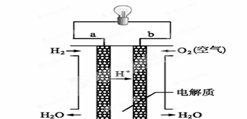
① 氢氧燃料电池的总反应化学方程式是:_________ ___。
② 电池工作一段时间后硫酸溶液的浓度____ _____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com