
【题目】下列不能用勒夏特列原理解释的事实是
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)![]() N2O4(g)组成的平衡体系,加压后颜色加深
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下:
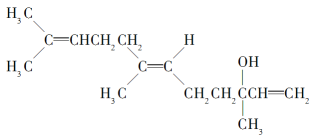
下列关于橙花醇的叙述,错误的是( )
A. 既能发生取代反应,也能发生加成反应
B. 在浓硫酸催化下加热脱水,可生成不止一种四烯烃(分子中含有四个碳碳双键的烯烃)
C. 1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D. 1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
己知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________。
Ⅱ. 生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
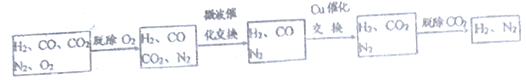
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ɑ2 (填“>”、“<”或“=”);平衡常数K_______(填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
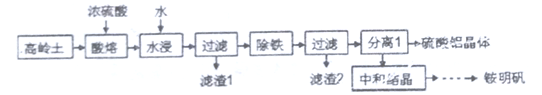
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g)![]() 2NH3(g) H<0合成氨,回答以下问题:
2NH3(g) H<0合成氨,回答以下问题:
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(H2)=_____________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1时刻后c(H2)的变化曲线并作相应的标注。_____________
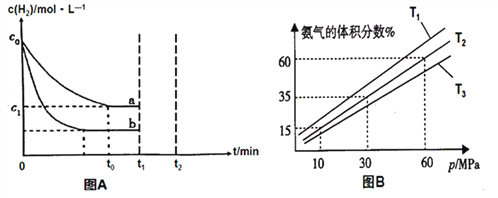
(2)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
① 比较T1、T3的大小T1__________T3(填“<”或“>”)。
②分析体系在T2、60MPa下达到的平衡,此时N2的平衡分压为_______MPa(分压=总压×物质的量分数);列式表示此时的平衡常数Kp=______________。(用平衡分压代替平衡浓度,不要求计算结果)
(3)有人利用NO2和NH3构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铜精炼,如图C所示,d极为粗铜。
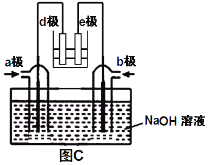
① a极通入________(填化学式);
② b极电极反应为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对酸碱的认识,已有几百年的历史,经历了一个由浅到深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿伦尼乌斯(Arrhenius)提出的酸碱电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿伦尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。酸碱溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨电离的方程式(生成的两种微粒电子数相等):_________。
(2)1923年丹麦化学家布朗斯特和英国化学家劳莱提出了酸碱质子理论。凡能够给出质子(氢离子)的任何物质都是酸;凡能够接受质子(氢离子)的物质都是碱。按质子理论:下列微粒在水溶液既可看作酸又可看作碱的是________(填字母)。
A.H2O B.NH![]() C.OH- D.HCO
C.OH- D.HCO![]() E.CH3COO- F.Cl-
E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合形成化学键的物质是酸。如:
H+ + [∶OH]-―→ H∶OH
酸(电子对接受体) 碱(电子对给予体) 反应产物
试指出下列两个反应中的酸或碱:
①H3BO3+H2O![]() H++B(OH)
H++B(OH)![]() ,该反应中的碱是________(填“H3BO3”或“H2O”)。
,该反应中的碱是________(填“H3BO3”或“H2O”)。
②NaH+H2O===NaOH+H2↑,该反应中的酸是________(填“NaH”'或“H2O”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温、同压下,有同质量的气体X和Y,已知此时Y的体积大于X的体积,则它们的摩尔质量之间的关系是( )
A.M(X)>M(Y)B.M(X)<M(Y)C.M(X)=M(Y)D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com