
| A. | X一定是碱金属元素 | |
| B. | Y元素能形成化合物Na2YO3,且其水溶液呈碱性 | |
| C. | Z元素形成的最高价氧化物熔点较低 | |
| D. | X的单质一定能通过电解Z的盐酸盐溶液制备 |
分析 X、Y、Z 均为短周期主族元素,其核电荷数依次增大,它们的原子最外层电子数之比为1:4:2,由于主族元素原子最外层电子数小于8,故X、Y、Z的最外层电子数依次为1、4、2,分别处于ⅠA、ⅣA、ⅡA族,结合原子序数可知,X可能为H或Li,Y为C元素,Z为Mg,结合元素化合物性质解答.
解答 解:X、Y、Z 均为短周期主族元素,其核电荷数依次增大,它们的原子最外层电子数之比为1:4:2,由于主族元素原子最外层电子数小于8,故X、Y、Z的最外层电子数依次为1、4、2,分别处于ⅠA、ⅣA、ⅡA族,结合原子序数可知,X可能为H或Li,Y为C元素,Z为Mg,
A.X可能为H或Li,不一定是碱金属元素,故A错误;
B.碳元素可以形成Na2CO3,且其水溶液呈碱性,故B正确;
C.MgO属于离子化合物,其熔点较高,故C错误;
D.X为Li时,不能通过电解LiCl溶液制备金属Li,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,关键是短周期主族元素结构特点确定元素,注意对基础知识的理解掌握,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c (CH3COOH)+c(CH3COO-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英与烧碱溶液共热:SiO2+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$SiO32-+H2O | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4OH-=[Al(OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L F2所含原子数为0.1NA | |
| B. | 4.4gCO2中氧分子的个数为0.1NA | |
| C. | 78g Na2O2固体中Na+的个数目为NA | |
| D. | 2.3gNa完全燃烧后失去电子的个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烷 | B. | 一定有丙烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 可能是甲烷和丁烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
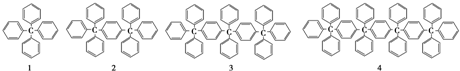
| A. | C158H118 | B. | C158H116 | C. | C160H116 | D. | C160H118 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点(℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | ∨ | ∨ | ∨ | ∨ | ||||||
| 与酸反应 | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ||||
| 与氧气反应 | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ∨ | ||
| 不发生化学反应 | ∨ | ∨ | ||||||||
| 相对于A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
| A | ||||||||||
| I | B | |||||||||
| J | ||||||||||
| H | ||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com