
| A. | 该反应属于置换反应 | |
| B. | 若铁粉过量,充分反应后溶液由蓝色变为棕黄色 | |
| C. | CuSO4具有氧化性 | |
| D. | 转移0.2mol电子,则固体质量增加了0.8g |
分析 Fe+CuSO4═Cu+FeSO4中,Fe元素的化合价升高,Cu元素的化合价降低,亚铁离子在溶液中显浅绿色,以此来解答.
解答 解:A.Fe置换硫酸铜溶液中的Cu,属于置换反应,故A正确;
B.若铁粉过量,硫酸铜全部被还原,生成硫酸亚铁溶液,亚铁离子在溶液中显浅绿色,故B错误;
C.Cu元素的化合价降低,则CuSO4是氧化剂,发生还原反应,故C正确;
D.转移0.2mol电子,消耗0.1molFe,生成0.1molCu,则固体质量增加了(64-56)×0.1=0.8g,故D正确;
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验室需要480 mL 2.0 mol•L -1的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 用溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 | |
| D. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
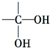 不稳定,则该有机物的结构简式为HOCH2CH2OH.
不稳定,则该有机物的结构简式为HOCH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 解释或结论 | |
| A | 将等体积的CH4和Cl2装入硬质大试管混合后,再将试管倒置于饱和食盐水中,在漫射光的照射下充分反应 | 试管内气体颜色逐渐变浅,试管内壁出现油状液滴 | 甲烷与氯气在光照条件下发生了取代反应 |
| B | 向盛有溴水的两试管中分别加入一定量的乙烯和苯 | 两试管中的水层都逐渐褪色 | 乙烯和苯都与溴水发生了加成反应 |
| C | 向盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠 | 钠浮在无水乙醇表面,反应比钠在水中更剧烈 | 乙醇结构中羟基氢的活性比水中的强 |
| D | 将乙醇和浓硫酸共热至170℃后,将生成的气体通入酸性KMnO4溶液中 | KMnO4溶液褪色 | 证明乙烯能使KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两电极上产生的气体质量之比为4:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为1:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com