
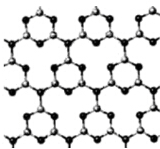
分析 该结构中最小重复单位为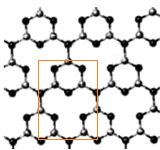 中红线内结构,每个C原子能形成4个共价键、每个N原子能形成3个共价键,根据原子成键特点知,黑色球表示N原子、灰色球表示C原子,根据均摊分确定化学式.
中红线内结构,每个C原子能形成4个共价键、每个N原子能形成3个共价键,根据原子成键特点知,黑色球表示N原子、灰色球表示C原子,根据均摊分确定化学式.
解答 解:该结构中最小重复单位为 中红线内结构,每个C原子能形成4个共价键、每个N原子能形成3个共价键,根据原子成键特点知,黑色球表示N原子、灰色球表示C原子,根据均摊分知,该最小重复单位中N原子个数=1+4×$\frac{1}{2}$+3×$\frac{1}{3}$=4,C原子个数=4×$\frac{1}{2}$+3×$\frac{1}{3}$=3,所以其化学式为C3N4,
中红线内结构,每个C原子能形成4个共价键、每个N原子能形成3个共价键,根据原子成键特点知,黑色球表示N原子、灰色球表示C原子,根据均摊分知,该最小重复单位中N原子个数=1+4×$\frac{1}{2}$+3×$\frac{1}{3}$=4,C原子个数=4×$\frac{1}{2}$+3×$\frac{1}{3}$=3,所以其化学式为C3N4,
故答案为:C3N4.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析判断及计算能力,正确判断最小重复单位是解本题关键,注意均摊分的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y都存在同素异形现象 | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为KHXOn═K++H++XOn2- | |
| B. | 该溶液中水的电离程度比纯水的小 | |
| C. | 该溶液能与NaOH溶液发生中和反应 | |
| D. | 若该溶液显酸性,则K1•K2>10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
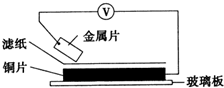 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应 2H2O+O2+4e-═4OH- | |
| B. | 表示H2燃烧热的热化学方程式 2H2(g)+O2 (g)═2H2O(g);△H=-483.6kJ/mol | |
| C. | 纯碱水解的离子方程式 CO32-+H2O?HCO3-+OH- | |
| D. | Ca(HCO3)2溶液中加入过量澄清石灰水 Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com