

���� �ɹ�������ͼ��֪�������ڿ���������ʱ��Cu�������������к���CuO������Ag���������м���������������CuO�����ᷴӦ�����˵õ�����ͭ��Һ���������ᣩ������AΪAg������Һ�м������������������ƣ��õ�����������������ͭ�������л�õ�CuO��Al2O3�����߷�Ӧ�õ�CuAlO2�����߷�Ӧ�õ�CuAlO2��
��1����ɫ��NO�ڳ�����������е�O2Ѹ�ٻ������ɺ���ɫN02��N02�����ת����������������
��2��δ���֮ǰ��Cu��OH��2��Al��OH��3������Al��OH��3��Cu��OH��2��ʼ�ֽ���¶ȷֱ�Ϊ450���80���жϲ������������������������Ӧ��
��3��������������֪��CuO��Al2O3��Ӧ�õ�CuAlO2���ɵ���غ��֪��OԪ�ػ��ϼ����ߣ����������ɣ���ƽ��ɷ���ʽ��
��4������ͭԪ���غ㽨����ϵʽ��Cu��CuAlO2�����㣻������Ԫ���غ㽨����ϵʽ��Al2��SO4��3��2CuAlO2�����㣻
��5����ͭ���Ͻ��м�������ϡ���ᣬͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ��
��� �⣺��1����ɫ��NO�ڳ�����������е�O2Ѹ�ٻ������ɺ���ɫN02��2NO+O2=2NO2��N02�����ת������������������Ӧ����ʽΪ��2NO2?N2O4��
�ʴ�Ϊ��2NO+O2=2NO2��2NO2?N2O4��
��2��δ���֮ǰ��Cu��OH��2��Al��OH��3��Al��OH��3��Cu��OH��2��ʼ�ֽ���¶ȷֱ�Ϊ450���80�棬��к�Cu��OH��2�ֽ��������ͭ����֪BΪAl��OH��3��CuO��������������������Ӧ��Al��OH��3+NaOH=NaAlO2+2H2O��
�ʴ�Ϊ��Al��OH��3��CuO��Al��OH��3+OH-=AlO2-+2H2O��
��3��������������֪��CuO��Al2O3��Ӧ�õ�CuAlO2���ɵ���غ��֪��OԪ�ػ��ϼ����ߣ����������ɣ���ӦǰCuΪ+2�ۣ���Ӧ��Ϊ+1�����ϼ۽���1����Ӧǰ��Ϊ-2�ۣ���Ӧ��Ϊ0�����ϼ�����2�����ߵ���С��������2���ٸ���ԭ���غ�ã�4CuO+2Al2O3=4CuAlO2+O2����
�ʴ�Ϊ��4��2��4CuAlO2��O2��
��4���ɹ�ϵʽ��Cu��CuAlO2��n��CuAlO2��=$\frac{5000g��63.5%}{64g/mol}$=50.0mol����CuAlO2Ϊ50.0mol��
�ɹ�ϵʽ��Al2��SO4��3��2CuAlO2��Al2��SO4��3=n��CuAlO2����$\frac{1}{2}$=25.0mol��������Ҫ���Ϊ$\frac{25.0mol}{1.0mol•L{\;}^{-1}}$=25.0L��
�ʴ�Ϊ��50.0��25.0��
��5����ͭ���Ͻ��м�������ϡ���ᣬͭ��ϡ���ᷴӦ��������ͭ��һ��������ˮ����Ӧ�����ӷ���ʽΪ3Cu+2NO3-+8H+=2NO��+4H2O+3Cu2+��
�ʴ�Ϊ��3Cu+2NO3-+8H+=2NO��+4H2O+3Cu2+��
���� �����Դӷ����л��������Ʊ�ͭ������ƷΪ�����������˵��ԭ�����������жϡ�������ԭ��Ӧ����ƽ�Լ���ѧ���㣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH+4 Na+ NO-3 Cl- | B�� | Fe2+ K+ HS- ClO- | ||
| C�� | Ca2+ K+ SO32- CH3COO- | D�� | K+ Na+ Cl- SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
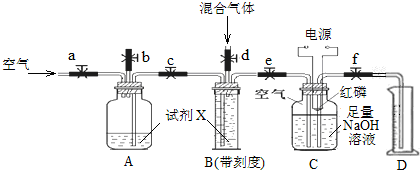
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
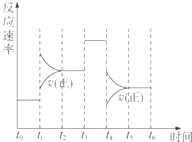 ������̶����ܱ���ϵ�з������з�Ӧ��
������̶����ܱ���ϵ�з������з�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��IO3��2����������Cu��IO3��2�е�ͭ�͵�Ԫ�ر���ԭ | |
| B�� | CuI���������������ǻ�ԭ���� | |
| C�� | ÿ����1 mol CuI����12 mol KI����������Ӧ | |
| D�� | ÿת��1.1 mol���ӣ���0.2 mol IO3-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ | B�� | �к�CH3COOH�Ķ� | C�� | �к�H2SO4�Ķ� | D�� | ���Ƚ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2+ H+ SO42- | B�� | Ba2+ NO3- CO32- | ||
| C�� | Al3+ H+ CO32- | D�� | OH- Cu2+ NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2+O2��2H2O+142.9kJ | B�� | 2H2��g��+O2��g����2H2O��l��+142.9kJ | ||
| C�� | 2H2��g��+O2��g����2H2O��l��+571.6kJ | D�� | H2O��l����H2��g��+$\frac{1}{2}$O2��g��-142.9kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com