
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
【答案】D
【解析】
根据价层电子对互斥理论确定中心原子杂化方式和价电子对互斥模型,根据孤电子对个数确定分子空间构型,据此分析判断。
A、SO2中心原子杂化方式sp2,价层电子对互斥模型为平面三角形,含有一个孤电子对,分子的立体构型为V型结构,故A错误;
B、HCHO分子中心原子杂化方式sp2,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,故B错误;
C、NF3分子中心原子杂化方式sp3,价层电子对互斥模型为四面体形,含有一个孤电子对,分子的立体构型为三角锥形,故C错误;
D、NH4+的中心原子杂化方式sp3,价层电子对互斥模型为正四面体形,没有孤电子对,离子的立体构型为正四面体形,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )

A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃饱和NaCl溶液密度为ρg·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是( )
A.温度低于20℃时,饱和NaCl溶液的浓度小于![]()
B.此溶液中NaCl的质量分数为![]()
C.20℃时,密度小于![]() 的NaCl溶液是不饱和溶液
的NaCl溶液是不饱和溶液
D.20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
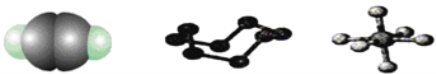
A. 32 g S8分子中含有0.125 mol σ键
B. SF6是由极性键构成的分子
C. 1 mol C2H2分子中有3 mol σ键和2 mol π键
D. S8中S的杂化方式为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与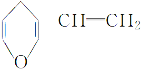 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C. 青蒿素 ![]() 的一氯取代物有(不含立体异构)有7种
的一氯取代物有(不含立体异构)有7种
D. 菲的结构简式为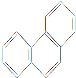 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)15.6gNa2X中含Na+0.4mol,则Na2X的摩尔质量是____________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是_________________(用含NA的式子表示)。
(3)某溶液由Mg2+、Al3+、Cl-、SO42- 4种离子组成,测得其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为___________。
(4)标况下,密度为1.25g/L的CO2与CH4组成的混合气体中,CO2的体积分数为______。
(5)将标准状况下体积为aL的HCl气体溶于1000g水中,得到盐酸的密度为bg/cm3,则该盐酸的物质的量浓度为______________mol/L。
(6)下列各项与胶体性质无关的有______________________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探索苯分子结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图所示),下列说法正确的是

A.五种物质均能与氢气发生加成反应
B.b、c、e的一氯代物均有三种
C.五种物质中,只有a分子的所有原子处于同一平面
D.a、b、c、e能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com