
【题目】向某Na2CO3、 NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与-1gc(Ba2+)的关系如图所示,下列说法不正确的是
与-1gc(Ba2+)的关系如图所示,下列说法不正确的是

A. 该溶液中![]() <
<![]()
B. B、D、E三点对应溶液pH的大小顺序为B>D>E
C. A、B、C三点对应的分散系中,A点的稳定性最差
D. D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32+)+c(OH-)+c(Cl-)
【答案】B
【解析】
A.结合Kh(CO32-)= c(HCO3-)·c(OH-)/c(CO32-);Kh(HCO3-)= c(H2CO3)·c(OH-)/c(HCO3-),混合溶液中两表达式c(OH-)相同,由于Kh(CO32-)>Kh(HCO3-) ,故![]() <
<![]() ,故A正确;B.根据Ka2=c(CO32-)·c(H+)/c(HCO3-),
,故A正确;B.根据Ka2=c(CO32-)·c(H+)/c(HCO3-), ![]() 的数值越大,c(H+)的浓度越小,酸性越弱,pH越大,因此正确的顺序为:B<D<E,故B错误;C.A、B、C三点对应的分散系中,A点属于过饱和溶液,会形成BaCO3沉淀,因此该分散系的稳定性最差,故C项止确;D.根据电荷守恒得:2c(Ba2+)+c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于D点对应的溶液中c(C032-)=c(HCO3-),因此存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32-)+c(OH-)+c(Cl-),故D项正确。答案:B。
的数值越大,c(H+)的浓度越小,酸性越弱,pH越大,因此正确的顺序为:B<D<E,故B错误;C.A、B、C三点对应的分散系中,A点属于过饱和溶液,会形成BaCO3沉淀,因此该分散系的稳定性最差,故C项止确;D.根据电荷守恒得:2c(Ba2+)+c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于D点对应的溶液中c(C032-)=c(HCO3-),因此存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO32-)+c(OH-)+c(Cl-),故D项正确。答案:B。


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】口服抗菌药利君沙的制备原料E和某种广泛应用于电子电器领域的高分子化合物H的合成路线如下:
已知:

I、核磁共振氢谱显示E分子中有两组峰,且峰面积比为2:1
Ⅱ、![]()
![]()
![]()
Ⅲ、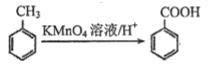
回答下列问题:
(1)丙烯的结构简式为_______________;E的分子式为_____________________;
(2)B分子中官能团的名称为__________________;G的名称为_______________________。
(3)由甲苯生成F的反应类型为_________________。
(4)写出C→D的化学方程式________________________________________________。
(5)满足下列条件的G的同分异构体有_________种。
①苯环上有三个取代基。②遇![]() 溶液发生显色反应。
溶液发生显色反应。
③能和![]() 溶液反应生成
溶液反应生成![]() 。
。
(6)写出1,3-丁二烯(![]() )和乙二醇(
)和乙二醇(![]() )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为__________。
(2)滤渣1的化学式为__________________。
(3)流程中“氧化”的氧化剂是:_________,写出该流程的离子方程式为______________。
(4)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
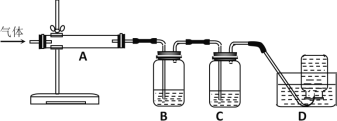
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。
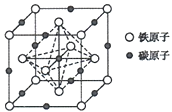
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)等质量的二氧化硫和二氧化碳,它们的物质的量之比___,所含原子数之比为___,同温同压下的密度之比为___。
(2)有氢原子数相等的甲烷和氨气(NH3)的质量之比为___。
(3)3.22g的Na2SO4·10H2O溶于水中,要使每100个分子中含有1个Na+,则需要水的质量为___。
(4)同温同压下某容器充满氮气重64g,充满氦气重52g,现在充满某气体重66g,则该气体的摩尔质量为___。
Ⅱ.(1)油画所用颜料含有某种白色铅化物,此颜料置于空气中长时间后就会变成黑色PbS,从而使油画的色彩变暗,若用双氧水H2O2来清洗,则可将PbS变成PbSO4,从而使油画复原。上述清洗反应的化学方程式为PbS+4H2O2=PbSO4+4M(已配平)。
生成物M的化学式为___ ;若发生转移的电子数目4mol时,参加反应的H2O2的质量为___。
(2)在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O中,氧化剂是___,氧化产物是___,氧化产物与还原产物物质的量之比是___,氧化剂和还原剂的物质的量之比为___,若有36.5gHCl被氧化,则产生Cl2的质量为___。
(3)2.3g的金属钠,在干燥的空气中被氧化后得到固体的质量为3.5g,则反应后固体中氧化钠的质量为___。
(4)配平下列方程式并用单线桥表示电子的转移(不需写出配平过程)___
Cu+HNO3(稀)=Cu(NO3)2+NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯乙酸(ClCH2-COOH)在有机合成中是一种重要的原料和中间体,在硫单质催化下干燥氯气与乙酸反应制得一氯乙酸:![]()
![]()
![]()
已知:

请回答下列问题:
(1)选用下图的装置制备一氯乙酸粗品。
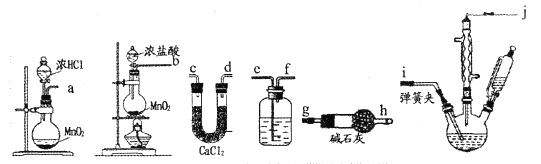
①按照气流从左至右依次连接的合理顺序为____→____→____→____→____→i→j→g→h(填接口字母)。____
②洗气瓶中的溶液为____,碱石灰的作用是____。
(2)制备一氯乙酸时,首先采用____(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹、____(填操作),如果三颈烧瓶溶液表面观察到大量 ___(填现象)时,应该___(填操作),以减少氯气通入量,以免浪费。
(3)一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有少量的____(填物质名称),再进行____(填“过滤”、“分液”或“重结晶”),可得到纯净的一氯乙酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com