
分析 (1)①根据正负总化合价之和相等进行分析;盐是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物;
②a.胶体较稳定;
b.溶液无丁达尔效应;
c.胶粒可透过滤纸;
(2)根据胶体的常见性质有丁达尔效应、电泳、聚沉、渗析和胶体的制备方法来分析.
解答 解:(1)①Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价;Fe(CrO2)2是由亚铁离子和CrO2-组成的盐,故答案为:+2;盐;
②a.胶体较稳定,溶液是稳定的,故A错误;
b.溶液无丁达尔效应,胶体有丁达尔效应,故B错误;
c.胶粒和溶液都可透过滤纸,故C正确;
故答案为:c;
(2)①肥皂水是胶体,故肥皂水中透过强光,可以见到光带.这种现象称为丁达尔效应,故答案为:丁达尔效应;
②胶体遇电解质溶液能发生聚沉,故在氢氧化铁胶体中加入氯化钠,产生红褐色沉淀,这种现象叫做聚沉,故答案为:聚沉;
③胶体不能透过半透膜,而溶液可以,将胶体和溶液用半透膜分离的方法叫渗析,故用半透膜把氢氧化铁胶体中含有的NaCl分离出来的方法叫做渗析,故答案为:渗析;
④胶粒带电,故在电场的作用下能向着电极的一方移动,此性质为电泳,故水泥厂和冶金厂常用高压直流电去除大量烟尘即利用的是电泳的性质,故答案为:电泳.
⑤制备Fe(OH)3胶体是将饱和的氯化铁溶液滴入沸水中,氯化铁即水解为氢氧化铁胶体和HCl,化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3 (胶体)+3HCl,故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3 (胶体)+3HCl.
点评 本题考查胶体的性质和化合价的计算,题目难度中等,注意胶体性质和氢氧化铁胶体制备方法的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | Al、Fe、Cu的单质放置在空气中均只生成氧化物 | |
| C. | SiO2与酸、碱均不反应 | |
| D. | 向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.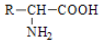 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com