
| A. | Ca(OH)2 | B. | Mg(OH)2 | C. | KOH | D. | NaOH |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 标准状况下,11.2L溴单质含有NA个溴原子 | |
| C. | 常温常压下,28g乙烯和丙烯的混合气体含有的原子总数为6NA | |
| D. | 1mol乙醇与1mol乙酸混合充分反应后生成乙酸乙酯分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
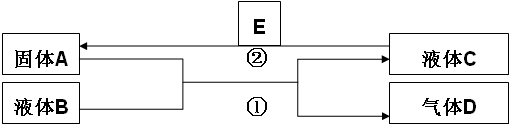
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: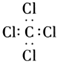 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
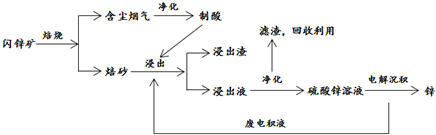
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com