
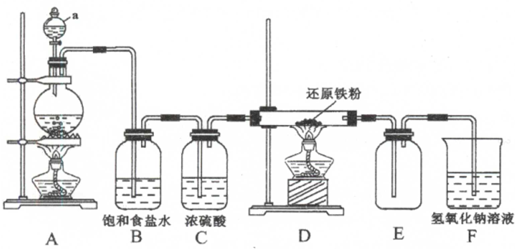
分析 根据题中提供的装置可知,该实验是用浓盐酸和二氧化锰加热制取氯气,浓盐酸具有挥发性,所以制取的氯气中含有HCl,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,然后将纯净、干燥的氯气和Fe加热制取FeCl3,氯气有毒不能直接排空,且氯气能和碱溶液反应,所以用NaOH溶液处理尾气,氯化铁易水解,为防止氢氧化钠溶液中的水份挥发到生成氯化铁的装置中,在产生氯化铁和尾气吸收装置之间要加干燥装置,氯化铁在100℃左右升华,生成的氯化铁在导管中容易冷却成固体,会堵塞导管,据此答题.
解答 解:根据题中提供的装置可知,该实验是用浓盐酸和二氧化锰加热制取氯气,浓盐酸具有挥发性,所以制取的氯气中含有HCl,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,然后将纯净、干燥的氯气和Fe加热制取FeCl3,氯气有毒不能直接排空,且氯气能和碱溶液反应,所以用NaOH溶液处理尾气,氯化铁易水解,为防止氢氧化钠溶液中的水份挥发到生成氯化铁的装置中,在产生氯化铁和尾气吸收装置之间要加干燥装置,氯化铁在100℃左右升华,生成的氯化铁在导管中容易冷却成固体,会堵塞导管,
(1)根据装置图可知,仪器a的名称是分液漏斗,F装置的作用是吸收未反应的氯气,防止污染环境,
故答案为:分液漏斗;吸收未反应的氯气,防止污染环境;
(2)D中发生反应为铁与氯气反应生成氯化铁,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3,A中发生的反应是浓盐酸与二氧化锰生成氯气的反应,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$3FeCl3;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)根据上面的分析可知,上述实验装置的设计还有不完善的地方,主要有导管易被产品堵塞,不安全;产品易受潮而水解,导致产品不纯,
故答案为:导管易被产品堵塞,不安全;产品易受潮而水解,导致产品不纯.
点评 本题考查氯气实验室制法、氯化铁的制备等知识点,侧重考查实验操作及盐类水解等知识,为高频考点,知道每个装置的作用及可能发生的反应,难点是实验装置先后顺序排列,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com