
| A. | H2SiO3 H2S CO2 | B. | H2O NH3•H2O H3PO4 | ||
| C. | H2SO3 BaSO4 CH4 | D. | MgSO4 CH3COOH CH3CH2OH |
分析 只有部分电离的电解质是弱电解质,弱酸、弱碱和水都属于弱电解质.
解答 解:A.H2SiO3 和 H2S属于弱酸是弱电解质,CO2本身不能电离出离子属于非电解质,故A错误;
B.H2O、NH3•H2O、H3PO4 水溶液中部分电离属于弱电解质,故B正确;
C.H2SO3 水溶液中部分电离属于弱电解质,BaSO4 熔融状态全部电离属于强电解质,CH4 不能电离属于非电解质,故C错误;
D.MgSO4 属于盐是强电解质,CH3COOH 水溶液中部分电离属于弱电解质,CH3CH2OH不能电离属于非电解质,故D错误;
故选B.
点评 本题考查了强弱电解质的划分,明确其划分标准是电解质的电离程度,掌握概念的实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:推断题
 ;
;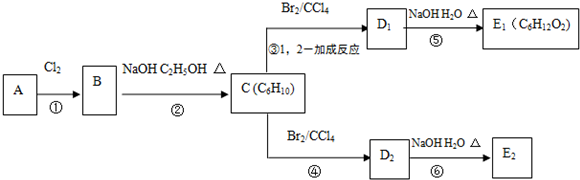

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X-、Y-、Z-、W-中Z-还原性最强 | B. | X2、Y2、Z2、W2中Z2的氧化性最强 | ||
| C. | 2Z-+Y2═-+Z2不能向右进行 | D. | 还原性X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
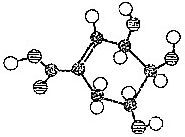
 的化学方程式:
的化学方程式: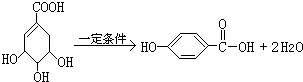 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com