
向10 mL 0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是:( )
A.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
B.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)<c(Al3+)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:选择题
下列除去杂质(括号里的为杂质)的试剂中正确的是
A.Cl2(HCl):饱和NaHCO3
B.NaCl溶液(Na2SO4):Ba(NO3)2溶液
C.NO(NO2):水
D.Al2O3(SiO2):NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:填空题
某烃分子量为72,现取3.6g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,求:
(1)该烃的分子式________________;
(2)己知该烃的一氯代物只有一种,写出该烃的结构简式___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:推断题
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.
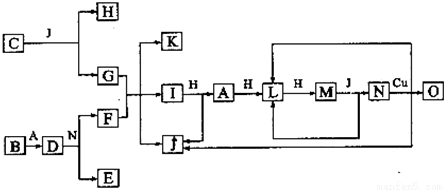
请回答下列问题:
(1)组成B单质的元素在周期表第 周期第 族 .化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有 个.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列有关实验原理、操作或现象不正确的是( )
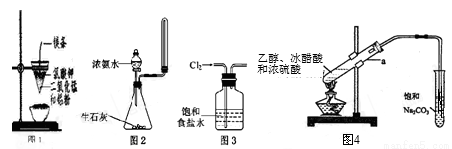
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.实验室用图4所示装置制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列化学用语正确的是( )
A.氧原子的结构示意图:
B.CCl4的电子式: 
C.CH4分子的比例模型: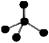
D.水分子的结构式:H—O—H
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
2Zn(OH)2•ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2•ZnCO3的工艺流程如下:

请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg 3Fe+4MgS,装置如图所示。下列说法不正确的是
3Fe+4MgS,装置如图所示。下列说法不正确的是
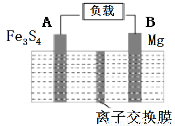
A.放电时,镁电极为负极
B.充电时,阴极的电极反应式为MgS+2e-=Mg+S2-
C.放电时, A极质量减少
D.图中所示离子交换膜应使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com