
| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |

���� ��1����Fe2O3��s��+3C��ʯī��=2Fe��s+3CO��g����H1=+489.0kJ•mol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJ•mol-1
��-�ڡ�3�õ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g�������ݸ�˹���ɼ��㷴Ӧ���ʱ䣻
��2����ѧƽ�ⳣ��K=$\frac{������ƽ��Ũ��ϵ���η��ij˻�}{��Ӧ��ƽ��Ũ��ϵ���η��ij˻�}$�������¶���ƽ�ⳣ���Ĺ�ϵ���ش�
��3����Ũ����Qc=1��С��ƽ�ⳣ������Ӧ������Ӧ���У���ƽ��ʱ�μӷ�Ӧ��COΪxmol����������ʽ��ʾ��ƽ��ʱ����ֵ����ʵ���������ƽ�ⳣ���з��̼��㣬�ڽ��ת���ʶ�����㣻
��a����Ӧǰ�����������仯��������䣬�������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬��
b�����������Ӳ�Ӱ�컯ѧƽ�⣬����Fe2O3�������CO��ת���ʣ�
c�����൱���ڼ�ƽ��Ļ����ϼ���1molCO����Ӧ���ʼӿ죻
d����������Ũ����Qc=0.125��С��ƽ�ⳣ������Ӧ������Ӧ���У���ƽ��ʱ���вμӷ�Ӧ��COΪymol����������ʽ��ʾ��ƽ��ʱ����ֵ����ʵ���������ƽ�ⳣ���з��̼��㣬��Ϣ��еļ����жϣ�
��4����ԭ��ص������͵��ص��������Եõ�������
��װ��Ϊԭ��أ�����dװ�ñ�������X���ĵ缫����Ӧ�������ã�
��5�������ܶȻ��������㣮
��� �⣺��1����Fe2O3��s��+3C��ʯī��=2Fe��s+3CO��g����H1=+489.0kJ•mol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJ•mol-1����-�ڡ�3�õ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g�������ݸ�˹���ɵõ���Ӧ���ʱ�=+489.0kJ•mol-1-3����+172.5kJ•mol-1��=-28.5kJ•mol-1��
��a=-28.5���ʴ�Ϊ��-28.5��
��2��Fe2O3��s��+3CO��g��$\frac{\underline{\;����\;}}{\;}$2Fe��s��+3CO2��g����ƽ�ⳣ��K=$\frac{{c}^{3}��C{O}_{2}��}{{c}^{3}��CO��}$���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ���ѧƽ�������ƶ����÷�Ӧ��ƽ�ⳣ��Kֵ����С���ʴ�Ϊ��$\frac{{c}^{3}��C{O}_{2}��}{{c}^{3}��CO��}$����С��
��3������T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����������Ũ����Qc=1��С��ƽ�ⳣ������Ӧ������Ӧ���У�������һ����̼���ʵ���Ϊx����
Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g��
��ʼ����mol����1 1
�仯����mol����x x
ƽ������mol����1-x 1+x
��Ӧǰ������������䣬���������ʵ�������Ũ�ȼ���ƽ�ⳣ������$\frac{��1+x��^{3}}{��1-x��^{3}}$=64�����x=0.6��
��CO��ת����=$\frac{0.6mol}{1mol}$��100%=60%
�ʴ�Ϊ��60%��
��a����Ӧǰ�����������仯��������䣬�������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬����a��ȷ��
b��Fe2O3Ϊ����������������������Ӱ�컯ѧƽ���ƶ����������CO��ת���ʣ���b����
c�����൱���ڼ�ƽ��Ļ����ϼ���1molCO����Ӧ���ʼӿ죬����������COƽ��ʱ�����ʸ��ߣ���c����
d����������Ũ����Qc=0.125��С��ƽ�ⳣ������Ӧ������Ӧ���У���ƽ��ʱ���вμӷ�Ӧ��COΪymol����
Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g��
��ʼ����mol����2 1
�仯����mol����y y
ƽ������mol����2-y 1+y
��Ӧǰ������������䣬���������ʵ�������Ũ�ȼ���ƽ�ⳣ������$\frac{��1+y��^{3}}{��2-y��^{3}}$=64�����y=1.4����ƽ��ʱ��������COΪ2mol-1.4mol=0.6mol���ɢ��еļ����֪ƽ��ʱ������COΪ1mol-0.6mol=0.4mol���ʼס���������CO��ƽ��Ũ��֮��Ϊ0.4mol��0.6mol=2��3����d��ȷ��
�ʴ�Ϊ��ad��
��4����aװ���������ӵ�Դ��������Ϊ����������������Ӧ�������丯ʴ��a����bװ���������ӵ�Դ�ĸ�����Ϊ�������ܱ�����������ʴ������ӵ�Դ��������������b��ȷ��cװ���У�п�������ã�п������������������������������������������c��ȷ���ʴ�Ϊ��bc��
����dװ���ܹ�����������X�Ļ�����Ӧ�������ã�ʹ�Ҳ�װ��Ϊԭ��أ����װ��Ϊ���أ�������ӵ�Դ��������������X������Zn��Al�Ȼ��õĽ������ʴ�Ϊ��п��
��5������������þ�������������ܽ�ƽ���Լ��ܶȻ�����ʽ�������ֳ�����������Һ��pH=8ʱ��
c��Mg2+��=$\frac{{K}_{sp}}{c��O{H}^{-}��^{2}}$=$\frac{5.61��1{0}^{-12}}{1{0}^{-12}}$�T5.61mol/L��
c��Fe3+��=$\frac{{K}_{sp}}{c��O{H}^{-}��^{3}}$=$\frac{2.64��1{0}^{-39}}{1{0}^{-18}}$=2.64��10-21mol/L��
���� c��Mg2+����c��Fe3+��=5.61��2��64��10-21=2.215��1021��
�ʴ�Ϊ��2.215��1021��
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã�ƽ�ⳣ������Ӧ�ã���ѧƽ������ʽ��ʽ���㷽����ԭ���ԭ���ķ����жϣ��ܶȻ������ļ��㣬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��AΪһ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ��Ϊ��ɫ��
��ͼ��AΪһ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ��Ϊ��ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����һ�ְ�ɫ��ĩ���ܽ��С��Na2CO3 | |
| B�� | ������200�����ң�����ȫ�ֽ⣬�����������ʣ�����NaHCO3��ȡ���� | |
| C�� | ��Na2CO3��ͬ����ʱ���ֱ���������ᷴӦ����NaHCO3�ɵõ��϶�Ķ�����̼ | |
| D�� | ����һ��̼���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij��Ӧ���ʱ�С���㣬�÷�Ӧһ�����Է����� | |
| B�� | ��ʪ���PH��ֽ��ϡ������Һ��pHΪ3.52 | |
| C�� | ԭ����ǽ���ѧ��ת��Ϊ���ܵ�װ�� | |
| D�� | ��ľ�ң�K2CO3���Ǽطʣ�������ǵ��ʣ������ʩ�ÿ�����߷�Ч |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
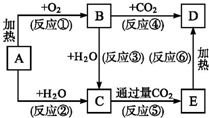
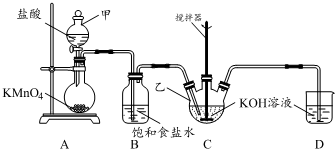 ʵ������ͼ��ʾװ���Ʊ�KClO��Һ����ͨ��KClO��Һ��Fe��NO3��3��Һ�ķ�Ӧ�Ʊ���Чˮ������K2FeO4��
ʵ������ͼ��ʾװ���Ʊ�KClO��Һ����ͨ��KClO��Һ��Fe��NO3��3��Һ�ķ�Ӧ�Ʊ���Чˮ������K2FeO4���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
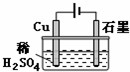
| A�� | �������У�ͭ�缫����H2���� | |
| B�� | �����ڣ�����Ӧ����ʽΪCu+H2SO4$\frac{\underline{\;ͨ��\;}}{\;}$CuSO4+H2�� | |
| C�� | ���һ��ʱ���ʯī�缫����ͭ���� | |
| D�� | �����������У�H+��Ũ�ȼ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȩ���Ľṹ��ʽ��-CHO | B�� | ����ĵ���ʽ��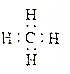 | ||
| C�� | ��Ȳ���ӵĽṹʽ��H-C��C-H | D�� | �Ҵ��ķ���ʽ��C2H5OH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com