
下列说法正确的是( )
A. 阿伏加德罗常数为6.02×1023
B. 摩尔质量等于该粒子的相对原子质量或相对分子质量
C. 1molH2的体积为22.4L
D. Na+的摩尔质量为23g/mol
考点: 阿伏加德罗常数;摩尔质量;气体摩尔体积.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.6.02×1023为阿伏伽德罗常数的近似值;
B.摩尔质量的单位为 g/mol,相对原子量或相对分子量没有单位;
C.标准状况下1mol氢气的体积约为22.4L;
D.钠离子的摩尔质量在数值上与钠原子的相对原子量相等.
解答: 解:A.1mol粒子中含有的相应粒子数为阿伏伽德罗常数,阿伏伽德罗常数的近似值为6.02×1023,故A错误;
B.摩尔质量与g/mol为单位时,在数值上与该粒子的相对原子质量或相对分子质量相等,故B错误;
C.没有告诉在标准状况下,1mol氢气的体积不一定为22.4L,故C错误;
D.钠的相对原子量为23,则钠离子的摩尔质量为23g/mol,故D正确;
故选D.
点评: 本题考查阿伏加德罗常数的有关计算和判断、摩尔质量与相对原子量或相等分子量的关系判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确摩尔质量与质量、相对原子量之间的关系.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列叙述中完全正确的一组是( )
①常温常压下,1mol甲基(﹣CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路中通过电子0.2NA
③5.6g铁粉与硝酸反应失去的电子数一定是0.3NA
④常温常压下,16gO2和O3的混合物中所含的原子数为NA
⑤1molC10H22分子中共价键总数为31NA
⑥1molCl2发生反应时,转移的电子数一定是2NA.
A. ②③④ B. ②③⑥ C. ①②④⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
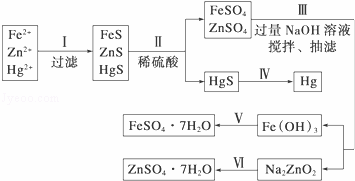
某工厂排出的污水中含有大量的Fe3+、Zn2+、Hg2+三种金属离子.以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4•7H2O)和汞的方案.
NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
如图
(1)步骤Ⅱ所发生反应的离子方程 .
步骤Ⅲ中抽滤的目的是 ,该步骤产生Fe(OH)3的反应的离子方程式为 .
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为 .
(4)欲实现步骤Ⅴ,需加入的试剂有 、 ,所涉及的主要操作依次为 .
(5)步骤Ⅳ常用的方法是 ,该步骤是否对环境有影响? (填“是”或“否”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应: .
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭发射的燃料有很多,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力.下列叙述中正确的是( )
A. 6.02×1023个偏二甲肼分子的质量为60g
B. 偏二甲肼的摩尔质量为60g
C. 1mol偏二甲肼的质量为60g/mol
D. 6g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4•7H2O进行消毒、净化,以改善水质
B. 铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等
C. 
从分类的角度看,混合物、分散系、胶体的从属关系如图所示:
D. 借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵
查看答案和解析>>
科目:高中化学 来源: 题型:
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是()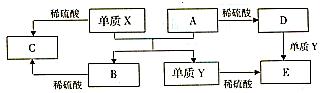
A. x与A反应的化学方程式是:Al2O3+2Fe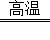 Fe2O3+2Al
Fe2O3+2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN﹣=Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com