
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.8 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
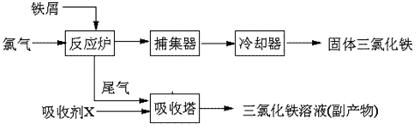
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,![]() 该过程可用离子方程式表示为: ▲ 。
该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3??6H2O的方法是: ▲ 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32—=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)用FeCl3溶液(32%~35![]() %)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+;
阴极反应为: ▲ 。
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三模底考试化学试卷(解析版) 题型:实验题
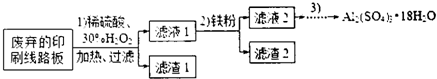
(15分)某探究小组废弃的印刷线路板(含Cu、A1少量Au、Pt等金属的混合物)回收Cu并制备硫酸铝晶体[A12(SO4)3.18H2O],设计路线如下:

(1)过滤时所需要的玻璃仪器有玻璃棒、 、 。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式:

①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 。
②滴定终点观察到的现象为 。
③若滴定前溶液中的H2O2没有除尽,所测定的 含量将会
(填“偏高”、“偏
含量将会
(填“偏高”、“偏
低”或“不变”)
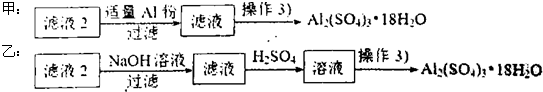
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:
乙:
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤。
②从原子利用率角度考虑, 方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.1 |
3.2 |
|
Fe2+ |
5.8 |
8.8 |
|
A13+ |
3.8 |
5.2 |
①氧化需加入H2O2而不用C12的原因是 。
②调节溶液pH约为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com