
分析 0.667g碳燃烧生成0.667molCO2,与1molNaOH反应生成Na2CO3和NaHCO3的混合物,由此分析解答.
解答 解:设Na2CO3和NaHCO3的物质的量分别为xmol和ymol,则$\left\{\begin{array}{l}{x+y=\frac{8}{12}}\\{2x+y=1}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=\frac{1}{3}}\\{y=\frac{1}{3}}\end{array}\right.$,故答案为:Na2CO3和NaHCO3、$\frac{1}{3}$mol和$\frac{1}{3}$mol.
点评 本题考查了根据反应方程式进行相关物质的计算,根据方程式中各个物理量的关系式进行计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
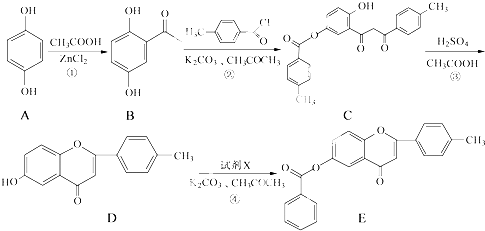
 .
.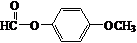 .
.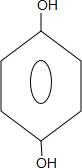 +CH3COOH$\stackrel{ZnCl_{2}}{→}$
+CH3COOH$\stackrel{ZnCl_{2}}{→}$ +H2O.
+H2O. .
.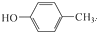 和CH3COOH为原料制备
和CH3COOH为原料制备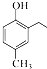 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
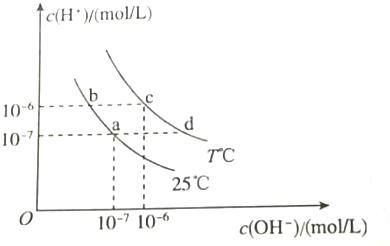
| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三角锥形、sp3 | B. | V形、sp2 | C. | 平面三角形、sp2 | D. | 三角锥形、sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
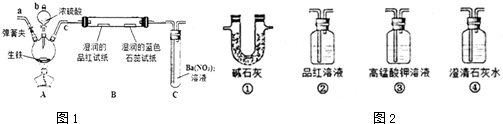
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com