

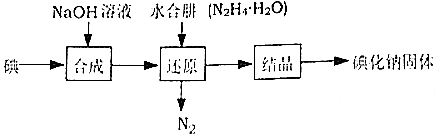
分析 以液氨为原料生产肼和亚硝酸钠的工艺流程(肼能与水混溶,形成稳定的N2H4•H2O):由氯气和氢氧化钠制备次氯酸钠溶液,次氯酸钠与氨气在一定条件下发生反应2NH3+NaClO$\frac{\underline{\;一定条件\;}}{\;}$N2H4•H2O+NaCl,得到N2H4•H2O溶液,提纯可得到产品,氨气与氧气生成一氧化氮和二氧化氮,通入氢氧化钠得到的溶液2中含有硝酸钠和亚硝酸钠,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硝酸钠与亚硝酸钠的固体混合物,再加入Pb,发生反应NaNO3+Pb═NaNO2+PbO,得到纯净的产品NaNO2,据此分析解答.
解答 解:(1)NaNO2中钠元素+1价,氧元素-2价,化合物中化合价的代数和为0,则氮元素化合价+3价;
故答案为:+3;
(2)NaClO溶液中通入NH3得到产品N2H4•H2O,氮元素化合价升高,则氯元素化合价降低有氯化钠生成,故反应方程式为:2NH3+NaClO$\frac{\underline{\;一定条件\;}}{\;}$N2H4•H2O+NaCl;
故答案为:2NH3+NaClO$\frac{\underline{\;一定条件\;}}{\;}$N2H4•H2O+NaCl;
(3)成品2溶液为硝酸钠与亚硝酸钠的混合溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到硝酸钠和亚硝酸钠的固体混合物;
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)该钠氮化合物中钠的质量分数为0.3538,设化合物为NaNx,则:$\frac{23}{23+14×3}$=0.3538,解得x=3,则
亚硝酸钠在一定条件下能与无水肼反应生成NaN3和水,发生的反应为:NaNO2+N2H4$\frac{\underline{\;一定条件\;}}{\;}$NaN3+
H2O,则氧化剂与还原剂的物质的量之比为1:1,氧化产物还原产物均为 NaN3;
故答案为:1:1;NaN3;
(5)固体混合物为硝酸钠和亚硝酸钠,若要获得NaNO2产品,则需要除去的物质为硝酸钠,使用Pb进行处理时,杂质硝酸钠能转变为NaNO2,而Pb转化成PbO,发生的反应为:NaNO3+Pb═NaNO2+PbO,NaNO2在邻苯二甲酸二丁酯中溶解度远大于在水中的溶解度,而另一钠盐则不具有该性质,若用有机溶剂邻苯二甲酸二丁酯处理成品固体混合物水溶液时,NaNO2 与另一钠盐通过分液的方法分离;
故答案为:NaNO3;NaNO3+Pb═NaNO2+PbO;分液.
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向100ml浓度均为1mol/LFeI2、FeBr2混合溶液中通入标况下4.48L的氯气:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入过量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
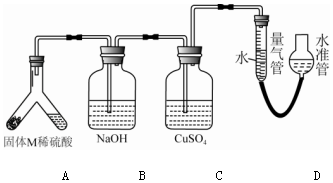
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
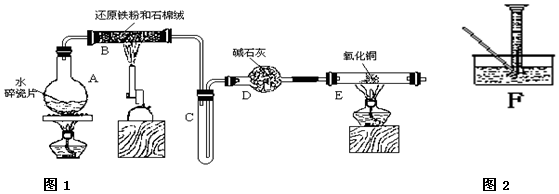
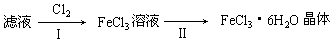
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com