


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
A.阴、阳两极都用石墨
B.铜作阳极,铁作阴极
C.铁作阳极,铜作阴极
D.铂作阳极,铜作阴极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市高三3月统一质量检测理综化学试卷(解析版) 题型:填空题
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 ???????????????????????????????????? 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是????? (填序号)
A.Ba(NO3)2? ???? B.BaCl2? ?? ? C.Ba(OH)2??? ???? D.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为?????????????????????????? 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作??????? 极(填“正”“负”“阴”或“阳”),其电极反应式为??????? ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为?????????? ,请判断T?????? 25℃(填“>”“<”“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如下图(其他无关物质已略去)。请回答下列问题:
| 单质X2 | 标准状况下密度为3.17 g?L-1 |
| 单质Y | 通常状况下为一种淡黄色固体 |
| 化合物Z | 焰色反应呈紫色(透过蓝色钴玻璃观察) |
| 常温下0.1 mol?L-1 Z的水溶液pH=13 |
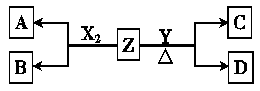
(1) Z的电子式为 。
(2)已知16 g固态单质Y在空气中完全燃烧放出148 kJ热量,则该反应的热化学方程式为 。
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①常温下D的水溶液pH>7,其原因是(用离子方程式表示) 。
②将20 mL 0.5 mol?L-1 C溶液逐滴加入20 mL 0.2 mol?L-1 KMnO4溶液(硫酸酸化)中,溶液恰好变为无色。写出该反应的离子方程式: 。
(4)①用石墨和铁作电极,在隔膜电解槽中电解A的溶液,阳极产生X2,电解A溶液的离子方程式为 。
②实验室常用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(石墨和铁作电极,温度为42~44 ℃)电解A的溶液生产化合物E。假设电解时电解槽进液口溶液中A 的浓度为2 mol?L-1,液口溶液中A的浓度为1.6 mol?L-1(进出口流量相同),则液口溶液中E的浓度为
mol?L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com