
| A. | pH=9.25、浓度均为0.1 mol•L-1的NH4C1、NH3•H2O混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| B. | 0.1mol/LH2SO4溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(SO42-)+c(OH-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3至pH=7:c(Na+)>c(SO32-)>c(NH4+) | |
| D. | CO2通入KOH溶液,当由水电离的H+浓度为10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-) |
分析 A、根据电荷守恒守恒进行分析;25℃时,c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)
B、据n=CV故两者物质的量相同,进行分析;
C、依据溶液中的电荷守恒和物料守恒进行分析;
D、没有注明状态.
解答 解:A、根据电荷守恒守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),NH3•H2O弱碱要发生部分电离,故0.1mol/L的氯离子浓度大于0.1mol/L的氨水的浓度,故c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-),故A正确;
B、H2SO4与NaOH浓度和体积相同,据n=CV故两者物质的量相同,即n(H2SO4)=n(NaOH),则n(H+)═n(SO42-)+n(OH-),故c(H+)═c(SO42-)+c(OH-),故B正确;
C、0.1mol•L-1的NaHSO3溶液中通NH3至pH=7,溶液中存在物料守恒,即c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)①,溶液中存在电荷守恒,即c(Na+)+c(H+)+c(NH4+)=2c(SO32-)+c(HSO3-)+c(OH-),因为pH=7即c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-)②,由①得c(Na+)>c(SO32-);将①式左右两边都加上c(NH4+)得c(Na+)+c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(NH4+)③,结合②③得c(SO32-)=c(NH4+)+c(H2SO3),故c(SO32-)>c(NH4+),故c(Na+)>c(SO32-)>c(NH4+),故C正确;
D、当在常温下由水电离的H+浓度为10-7mol/L,说明溶液呈中性,则c(H+)=c(OH-)①,根据电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)②,由①②得,c(K+)=2c(CO32-)+c(HCO3-),若条件发生改变此式不一定成立,故D错误,
故选D.
点评 本题考查了盐的水解、离子浓度大小比较,以及电荷守恒,物料守恒的应用等,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握影响电离平衡的因素.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:多选题
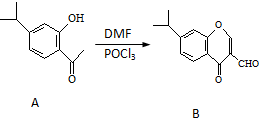 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中至少有8个碳原子位于同一平面 | |
| B. | 1molA与浓溴水发生取代反应时,最多消耗3molBr2 | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与6mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气化学性质通常不活泼,可将炽热的镁粉放在氮气中冷却 | |
| B. | 明矾溶于水能形成胶体,可用于自来水的杀菌消毒 | |
| C. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| D. | 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号); ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(溴:)加氢氧化钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水:)加入新制生石灰,蒸馏 | |
| C. | 苯(苯酚:)加氢氧化钠溶液,充分振荡静置后,分液 | |
| D. | 乙烷(乙烯:)通入高锰酸钾溶液,洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com