
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
分析 根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+恰好转化为AlO2-,先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算即可.
解答 解:MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2mol•L-1,Cl-浓度为1.3mol•L-1,
设Al3+的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则将Mg2+、Al3+的物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
由发生反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.04mol 0.08mol
AlCl3 +4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.06mol 0.24mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4mol•L-1NaOH溶液的体积为$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
故选C.
点评 本题考查离子的分离及利用化学反应方程式的计算,题目难度中等,明确Mg2+全部转化为沉淀分离出来发生的化学反应是解答本题的关键,并注意利用氢氧化铝的两性来解答.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、CO32- | B. | NH4+、Na+、SO42- | C. | Mg2+、HCO3-、Cl- | D. | Ag+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处于第5周期 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
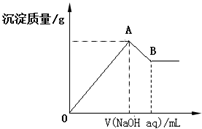
| A. | x=$\frac{3a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值不随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
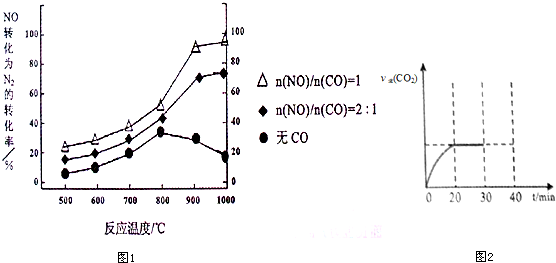
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
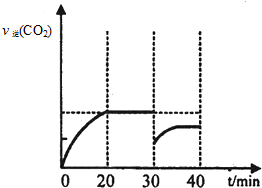 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com