
| A. | NaOH | B. | Cl2 | C. | HCl | D. | NaCl |
科目:高中化学 来源: 题型:选择题
| A. | 使用过量的乙酸 | B. | 采用边反应边蒸馏的方法 | ||
| C. | 反应采用水浴加热 | D. | 用氢氧化钠溶液提纯乙酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |

| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
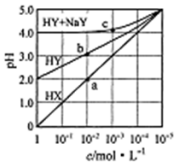 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭还原氧化铜的硬质玻璃管(盐酸) | |
| B. | 碘升华实验的试管(酒精) | |
| C. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+首先反应,转化为Fe | B. | 反应开始时c(Fe2+)增大,然后又减小 | ||
| C. | Fe2+首先反应,转化为Fe | D. | 存在反应Fe+Cu2+→Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①氯气使布条褪色 ②盐酸使布条褪色 ③次氯酸使布条褪色 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:把红色布条伸入稀盐酸中,红色布条不褪色 实验③:把红色布条伸入氯水中,红色布条褪色 实验④:把红色布条放在水里,布条不褪色. | 结论: 次氯酸使布条褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com