
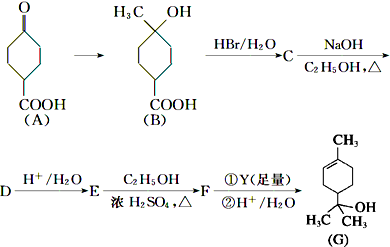
 ,C发生消去反应生成D为
,C发生消去反应生成D为 ,D水解反应得到E为
,D水解反应得到E为 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为 ,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr,据此解答.
,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr,据此解答. ,C发生消去反应生成D为
,C发生消去反应生成D为 ,D水解反应得到E为
,D水解反应得到E为 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为 ,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr,
,F发生信息反应生成G为,结合F与G的结合可知Y为CH3MgBr, ,属于取代反应;E→F是
,属于取代反应;E→F是 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成 ,也属于取代反应,
,也属于取代反应,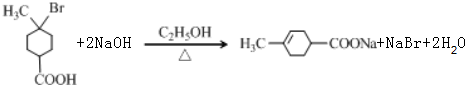 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、化合物KCrO2中Cr元素为+3价 |
| B、实验①证明Cr2O3是两性氧化物 |
| C、实验②证明氧化性:Cr2O72-<I2 |
| D、实验③证明H2O2有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-═CaCO3↓+CO32-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-═CuS↓ |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
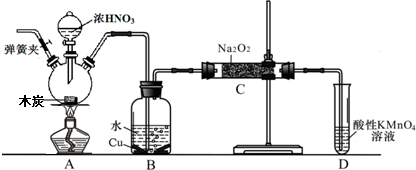
查看答案和解析>>
科目:高中化学 来源: 题型:
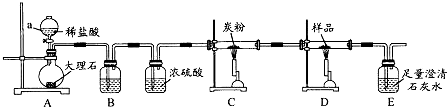
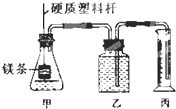 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
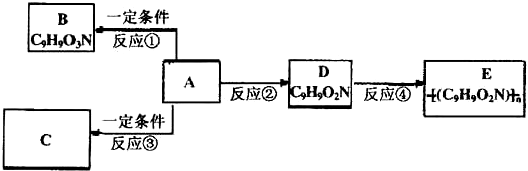
| 反应 | 反应类型 | 反应条件 |
| ② | ||
| A→B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com