
| A. | 12.7 | B. | 12.0 | C. | 13.0 | D. | 13.7 |
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①② | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| B. | 将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快 | |
| C. | 将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 | |
| D. | 两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
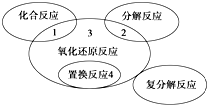 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 C CO2 CO NaHCO3 | |
| B. | Na2S S SO2 Na2SO3 Na2SO4 | |
| C. | NH4Cl N2 NaNO2 NO2 HNO3 | |
| D. | P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com