
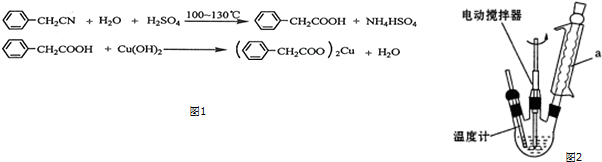
分析 (1)由图可知,a为冷凝管,可冷凝回流产物;
(2)由信息可知,微溶于冷水,则冷水降低其溶解度,然后过滤分离;
(3)将苯乙酸粗品进一步提纯,结合苯乙酸的熔点为76.5℃,可升华分析;
(4)用蒸馏水洗涤沉淀,若洗涤干净,表面不含氯离子;
(5)混合溶剂中乙醇可增大苯乙酸的溶解.
解答 解:(1)由图可知,a为球形冷凝管,其作用是冷凝回流,防止苯乙酸的挥发而降低产品产率,
故答案为:球形冷凝管;冷凝回流,防止苯乙酸的挥发而降低产品产率;
(2)由信息可知,微溶于冷水,则冷水降低其溶解度,加入冷水的目的是便于苯乙酸结晶析出,然后过滤分离,过滤需要烧杯、漏斗、玻璃棒,
故答案为:便于苯乙酸结晶析出; BCE;
(3)苯乙酸的熔点为76.5℃,可升华,且苯乙酸微溶于冷水,溶于乙醇,则将苯乙酸粗品进一步提纯,选择的实验方法是重结晶、升华,
故答案为:重结晶、升华;
(4)用蒸馏水洗涤沉淀,若洗涤干净,表面不含氯离子,则判断沉淀洗干净的实验操作和现象是取少量最后一次洗涤液于试管中,加入稀硝酸,再加AgNO3溶液,无白色沉淀(或白色浑浊)出现,
故答案为:取少量最后一次洗涤液于试管中,加入稀硝酸,再加AgNO3溶液,无白色沉淀(或白色浑浊)出现;
(5)混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验操作、物质的性质及混合物分离提纯、离子检验等为解答的关键,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
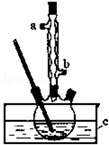 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com