
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
分析 (1)根据c=$\frac{1000ρω}{M}$计算出浓盐酸的物质的量浓度,再根据稀释定律计算所需浓盐酸的体积;
根据所配溶液的体积选择容量瓶的规格;
根据配制溶液的实验操作步骤选择所需仪器;
(2)依据配制一定物质的量浓度溶液一般步骤排序;
(3)烧杯壁沾有溶质,将洗涤液都移入容量瓶,保证溶质全部转移到容量瓶内;
(4)分析操作对溶质的物质的量、溶液的体积的影响,根据c=$\frac{n}{V}$判断对浓度的影响.
解答 解:(1)浓盐酸的物质的量浓度=$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,
配制250mL0.1mol•L-1的盐酸溶液,故需要250mL容量瓶,
令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以V×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,还缺少的仪器:玻璃棒、胶头滴管、量筒;
故答案为:
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
| 2.1 | 250 | 量筒、玻璃棒、胶头滴管 |
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理及操作步骤是解题关键,题目难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C<N<O<F | B. | 最高正化合价:Si<P<S<Cl | ||
| C. | 热稳定性:GeH4<SiH4<CH4 | D. | 酸性:H3CO3<H2SiO3<Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
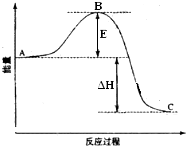 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ①③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
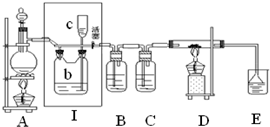 如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由弱至强的顺序是X<Y<Z | |
| C. | 原子半径大小顺序是X<Y<Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com