
| A. | 恒温恒容,达平衡后再充入N2O4气体,NO2百分含量变小 | |
| B. | 增大压强,平衡向正反应方向移动,混合气体颜色变浅 | |
| C. | 达平衡后,升高温度,△H减小 | |
| D. | 2v正(NO2)═v逆(N2O4)说明反应达到化学平衡状态 |
分析 A、恒温恒容,达平衡后再充入N2O4气体,相当给原平衡体系增加压强;
B、增大压强,平衡向气体体积缩小的正反应方向移动,移动的结果,是减弱而不是抵消;
C、达平衡后,升高温度,平衡逆向移动,但△H不变;
D、平衡状态应有v正(NO2)═2v逆(N2O4).
解答 解:A、恒温恒容,达平衡后再充入N2O4气体,相当给原平衡体系增加压强,平衡正向移动,二氧化氮的百分含量变小,故A正确;
B、增大压强,平衡向气体体积缩小的正反应方向移动,移动的结果,是减弱而不是抵消,所以达到新平衡时二氧化氮的浓度比原体系中浓度大,混合气体颜色变深,故B错误;
C、达平衡后,升高温度,平衡逆向移动,所以△H不变,故C错误;
D、平衡状态应有v正(NO2)═2v逆(N2O4)故D错误;
故选A.
点评 本题考查化学平衡的影响因素及平衡移动,注意把握恒容及物质的量与压强的关系是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
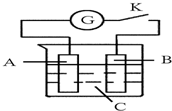 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| B. | 2.3 g钠在足量的氧气中燃烧,钠失去的电子数为0.2NA | |
| C. | 标准状况下,2g氢气所含原子数目为NA | |
| D. | 100mL0.2mol/L BaCl2溶液中Cl-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 | |
| B. | HF可以用于刻蚀玻璃 | |
| C. | 镁铝合金可用作制造飞机的材料 | |
| D. | 过氧化钠可用作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该样品中一定含有NH4HC03和NH4Cl | |
| B. | 该样品中含N元素的质量分数为17.57% | |
| C. | 该样品若和足量烧碱反应,将消耗0.4mol NaOH | |
| D. | 根据上述数据可以确定原样品中含有5.3g NH4N03 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com