
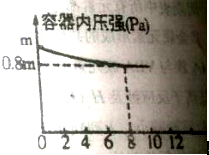
| △c |
| t |
| △c |
| t |
| ||
| 8min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol甲苯含有C-H键数目为8NA | ||
| B、1 mol丙烯酸中含有双键的数目为NA | ||
C、由a g C2H4和C3H6组成的混合物中所含共用电子对数目为
| ||
| D、在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(Fe3+) |
| n(Fe2+) |
| n(Fe3+) |
| n(Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(OH-)=c(A- )+c(H+) |
| B、c(Na+)=c(A-)+c(HA) |
| C、c(Na+)>c(OH-)>c(A-)>c(H+) |
| D、c(Na+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2、P2O5均能溶解在NaOH溶液中反应生成盐和水 |
| B、CuS,CaC2,Na2O2均能与稀硫酸反应产生气体 |
| C、F,Cl,Br,I的单质和氢化物的沸点随原子序数的增大而升高 |
| D、Li,Na,Mg,Al的最高价氧化物对应水化物的碱性逐渐减低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| SOCI2 |
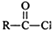
 +
+ →
→ +HCI
+HCI 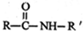
| NaOH溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:
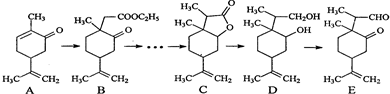
| LiBH4 |
| THF |
| LiBH4 |
| THF |
| CH3I |
| 催化剂 |
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com