
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
【答案】0.735 0③⑦由方程式确定关系式:Cr~3Na2S2O3,然后进行计算。
n(S2O32-)=0.02 L![]() 0.015 mol·L-1=3
0.015 mol·L-1=3![]() 10-4mol
10-4mol
n(Cr)=1![]() 10-4mol
10-4mol
m(Cr)=1![]() 10-4mol
10-4mol![]() 52 g·mol-1=5.2
52 g·mol-1=5.2![]() 10-3g=5.2 mg
10-3g=5.2 mg
废水中铬元素总浓度=5.2mg/0.025L=208 mg·L-1由无色变蓝色,半分钟内不褪色18.10(3.620×10-3M)/W×100%
【解析】
根据m=nM=cVM得:m(K2Cr2O7)=0.01000mol·L-1×0.250L×294.0g·mol-1=0.7350g,配置一定物质的量浓度的溶液,一般电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,加速溶解,用玻璃棒引流,将溶液移入容量瓶中,继续加水至离刻度线1~2cm处,改用胶头滴管加水定容,所以用不到的仪器为量筒和移液管,故③⑦用不到,故选③⑦。
(2)由①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O ③I2+2S2O32-===2I-+S4O62-
可得关系式:,2Cr3+![]() Cr2O72-
Cr2O72-![]() 6I-
6I-![]() 6S2O32-
6S2O32-
n(Na2S2O3)= 0.015 mol·L-1![]() 20.00 mL=3
20.00 mL=3![]() 10-4mol,则n(Cr3+)= 3
10-4mol,则n(Cr3+)= 3![]() 10-4mol
10-4mol
m(Cr)= 1![]() 10-4mol
10-4mol![]() -1=5.2
-1=5.2![]() 10-3g=5.2mg
10-3g=5.2mg
废水中铬元素总浓度c=5.2mg/0.025L=208 mg·L-1。答案:铬元素总浓度208 mg·L-1。
(3)①滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化是由无色变蓝色,半分钟内不褪色;
②根据图示的滴定管中液面可知,滴定管中初始读数为0,滴定终点液面读数为18.10mL,所以消耗碘的标准溶液体积为18.10mL;
根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以Wg产品中含有Na2S2O35H2O质量为:0.1000 molL-1×18.10×10-3L×2×M=3.620×10-3Mg,则产品的纯度为:(3.620×10-3M)/W×100%。


科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是( )
A. 过氧化钠的化学式: Na2O2
B. Mg2+的结构示意图: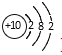
C. 明矾的化学式:Al2(SO4)3
D. 碳酸氢钠的电离方程式:CH3COOH=H+ + CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下(氯化过程中少量Ca(ClO)2 分解为CaCl2和O2):
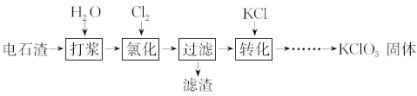
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①生成Ca(ClO)2的化学方程式为__________________________________________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。请回答:
①滤渣的主要成分为__________(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] :n[CaCl2]________1∶5(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
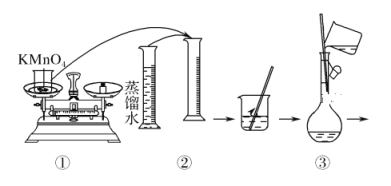
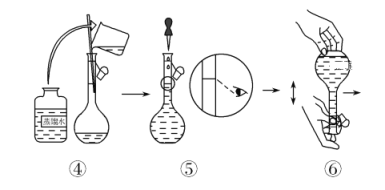
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
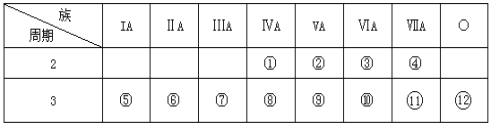
(1)写出①、②两种元素的名称______ ,______。
(2)这些元素的最高价氧化物的对应水化物中________碱性最强;能形成两性氢氧化物的元素是________。
(3)比较⑤与⑥的化学性质,________更活泼,试用实验证明此现象(简述操作、现象和结论) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 +2OH-![]() Cu(OH)42-(深蓝色)。某同学进行下列实验:
Cu(OH)42-(深蓝色)。某同学进行下列实验:
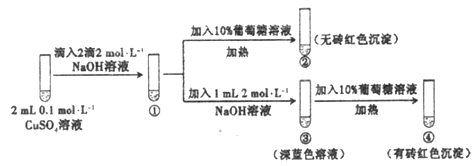
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2+ 2OH-![]() Cu(OH)42-正向移动的结果
Cu(OH)42-正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com