
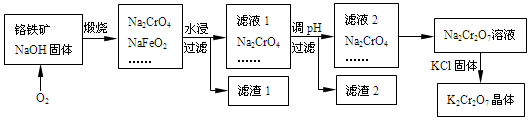
分析 铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2杂质,将铬铁矿和氢氧化钠、氧气混合焙烧,发生反应①4FeO•Cr2O3+7O2+20NaOH $\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,②2NaOH+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+H2O;
然后水浸、过滤得到滤渣1和滤液1,根据信息①知,滤液1中溶质是Na2CrO4、Na2SiO3、NaOH,滤渣1为Fe(OH)3,再调节溶液的pH,使硅酸盐完全沉淀,根据信息②知,溶质变为Na2Cr2O7,然后加入KCl固体,因为Na2Cr2O7的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,据此分析解答.
解答 解:(1)根据化合价规则:化合物中各个元素的化合价代数和是0,K是+1价,O是-2价,所以K2Cr2O7中Cr元素的化合价是+6;
故答案为:+6;
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式为4FeO•Cr2O3+7O2+20NaOH $\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,该反应中Cr元素和O元素化合价升高被氧化,生成的氧化产物为:Na2CrO4、NaFeO2;
故答案为:10H2O;Na2CrO4、NaFeO2;
(3)水浸发生NaFeO2的水解:NaFeO2+2H2O=NaOH+Fe(OH)3↓,操作Ⅰ是过滤,得到滤渣1为Fe(OH)3;滤液1中溶质是Na2CrO4、Na2SiO3、NaOH,调节溶液的pH,使硅酸盐完全沉淀硅酸,则滤渣2 为H2SiO3;
故答案为:NaFeO2+2H2O=NaOH+Fe(OH)3↓;H2SiO3;
(4)滤液2存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,平衡向正方向移动,
A.加酸,平衡向正方向移动,达到新平衡后,溶液PH减小,错误,
B.平衡向正方向移动,再达到新平衡前,正反应速率一定大于逆反应速率,正确,
C.温度不变,该反应平衡常数可以不改变,正确,
D.达新平衡后,CrO42-的消耗速率是Cr2O72-的消耗速率的2倍,错误;
故答案为:B、C;
(5)①还原过程为Cr2O72-被Fe2+还原为Cr3+的反应,离子方程为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②常温下,当c(Cr3+)降至1×10-3•mol•L-1,溶液的pH应调至4时,c(OH-)=10-10mol/L,Qc=c(Cr3+)•c(OH-)3=1×10-33<Ksp=1×10-32,故无沉淀生成;
故答案为:没有.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Q 与 W不能形成 10电子、14电子、18 电子分子 | |
| B. | Y 的最高价氧化物对应水化物的化学式只能表示为 H4YO4 | |
| C. | Y、Z、Q 分别与 X 化合,只能形成 AB2型化合物 | |
| D. | X、Z、W 中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:4:1 | B. | 1:1:1:1 | C. | 2:1:2:1 | D. | 1:2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2Cl2的结构式为Cl-S-S-Cl | |
| B. | S2Cl2中S原子的杂化类型为sp2杂化 | |
| C. | S2Cl2分子中各原子核外最外层电子均达到8电子稳定结构 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于杀菌、消毒 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁能源 | |
| C. | 氯气和明矾均可做自来水的消毒剂 | |
| D. | 食品保鲜剂中所含铁粉和生石灰均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾作净水剂 | |
| B. | 黄河入海口处容易形成沙洲 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 将植物油倒入水中用力搅拌可形成油水混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com