
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应
式是:Zn+2OH--2e-===ZnO+H2O; Ag2O+H2O+2e-===2Ag+2OH- 下列说法
正确的是
A.Zn为正极,Ag2O为负极
B.Ag2O发生还原反应
C.原电池工作时,正极区溶液pH值减小
D.原电池工作时,负极区溶液pH值增大
科目:高中化学 来源: 题型:
分析下图中各物质的转化关系。
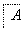
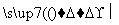
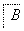
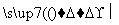
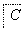
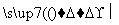
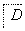
已知A是地壳中含量最高的金属元素单质。
(1)写出B、D的化学式:B________;D________。
(2)写出离子方程式:
C→D_______________________________________________________;
B+CO2→D__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是( )
A. H3BO3的酸性比H2CO3的强
B. Mg(OH)2的碱性比Be(OH)2的强
C. HCl、HBr、HI的热稳定性依次增强
D. 若M+和R2﹣的核外电子层结构相同,则原子序数:R>M
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
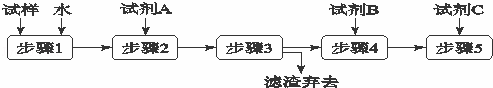
|
| A. | 步骤3的操作名称是过滤 |
|
| B. | 步骤1所需玻璃仪器是烧杯和玻璃棒 |
|
| C. | 试剂A是BaCl2溶液 |
|
| D. | 加入试剂A 的目的是除去CO32﹣并避免对Cl﹣或OH﹣的检验的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 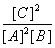
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
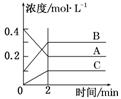 下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/ mL | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m= ,
n= 。如果研究温度对化学反应速率的影响,需利用实验4和 。
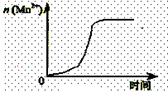 (2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 |
| t3 |
②能说明该小组同学提出的假设成立的实验事实是 。
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
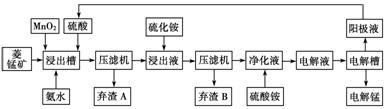
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。

已知: 由E二聚得到
由E二聚得到
完成下列填空:
(1)A的名称是________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式______________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式: _________________________________________ ____________________________。
____________________________。
鉴别这两个环状化合物的试剂为__________________________________________。
(4)以下是由A制备工程塑料PB的原料之一1,4丁二醇(BDO)的合成路线:

写出上述由A制备BDO的化学反应方程式:
_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com