
ijǿ������ҺX����Ba2+��Al3+��NH4+��Fe2+��Fe3+��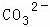 ��
��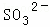 ��
��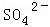 ��Cl����
��Cl����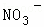 �е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������£�
�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������£�
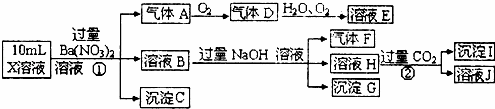
����������Ϣ���ش��������⣺
��1����ҺX�г�H+��϶����е�����������������ȷ���Ƿ��е������ǣ���Ҫȷ�����������ӵĴ��ڣ���ɿ��Ļ�ѧ������������
����G�Ļ�ѧʽΪ��
��3��д���й����ӷ���ʽ������
�����������A��
��������ɳ���I��
��4������ⶨA��F��I��Ϊ0.01mol��10mLX��Һ��n��H+��=0.04mol��������C���ʵ���0.07mol����˵����1���в���ȷ���������Ӵ��ڵ������ǣ�������
���㣺 �������ӵļ��鷽�������ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�ã�
ר�⣺ ���ӷ�Ӧר�⣮
������ ��ǿ������Һ��һ���������CO32����SO32�����ӣ�����������ᱵ���ɳ�������ó���ΪBaSO4������˵����Һ�к���SO42�����ӣ���������A��A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���ӣ���ҺB�м������NaOH��Һ����������F����FΪNH3��˵����Һ�к���NH4+���ӣ���ҺH������CO2���壬���ɳ���I����IΪAl��OH��3��HΪNaAlO2��˵����Һ�к���Al3+���ӣ���Һ�к���Fe2+���ӣ���һ������NO3�����ӣ�����SO42�����Ӿ�һ������Ba2+���ӣ�����ȷ���Ƿ��е�����Fe3+��Cl�����Դ˽��1����3���⣬������Һ�����Խ��4���⣮
��� �⣺��1����ǿ������Һ��һ���������CO32����SO32�����ӣ�����������ᱵ���ɳ�������ó���ΪBaSO4������˵����Һ�к���SO42�����ӣ���������A��A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���ӣ���ҺB�м������NaOH��Һ����������F����FΪNH3��˵����Һ�к���NH4+���ӣ���ҺH������CO2���壬���ɳ���I����IΪAl��OH��3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+���ӣ���Һ�к���Fe2+���ӣ���һ������NO3�����ӣ�����SO42�����Ӿ�һ������Ba2+���ӣ�����ȷ���Ƿ��е�����Fe3+��Cl�������������ӷ����ǣ�ȡ����X��Һ�����Թ��У����뼸��KSCN����Һ�����ɫ˵����Fe3+��
�ʴ�Ϊ��Al3+��NH4+��Fe2+��SO42����Fe3+��Cl����ȡ����X��Һ�����Թ��У����뼸��KSCN����Һ�����ɫ˵����Fe3+��
Fe2+���ӱ�����ΪFe3+���ӣ�����NaOH��Һ������Fe��OH��3��
�ʴ�Ϊ��Fe��OH��3�� ��3����Fe2+���ӱ�����ΪFe3+���ӣ���Ӧ�����ӷ���ʽΪ3Fe2++NO3��+4H+=3Fe3++NO��+2H2O����HΪNaOH��NaAlO2����ͨ�����������̼�����ɳ����ķ�ӦΪ��AlO2��+CO2+2H2O=Al��OH��3��+HCO3����
�ʴ�Ϊ��3Fe2++NO3��+4H+=3Fe3++NO��+2H2O��AlO2��+CO2+2H2O=Al��OH��3��+HCO3����
��4��ANO��F������I����������Ϊ0.01mol��10mL X��Һ��n��H+��=0.04mol�����ݷ�Ӧ3Fe2++NO3��+4H+=3Fe3++NO��+2H2O����֪Fe2+���ʵ���Ϊ0.03mol�� ̼��Һ�������Ϊ��2n��Fe2+��+3n��Al3+��+n��NH4+��+n��H+��=2��0.03mol+3��0.01mol+0.01mol+0.04mol=0.14mol������CΪ���ᱵ�������ʵ���0.07mol��n��SO42����=0.07mol����������������ĸ����Ϊ��0.07mol��2=0.14mol��˵����Һ�����������ȣ�����������Fe3+�϶�����ʱ������Cl�����ڣ���϶����ڵ����ӵ����������ȣ�
�ʴ�Ϊ��������Fe3+�϶�����ʱ������Cl�����ڣ���϶����ڵ����ӵ����������ȣ�
������ ���⿼�����ʵļ�������𣬸����Ǹ߿��еij������ͣ������е��Ѷȵ����⣬�����ۺ���ǿ���ѶȽϴ�����������ѧ������˼ά�����ͷ�ɢ˼ά���������ѧ����Ӧ��������ѧϰЧ�ʣ�����������Ҫע����ǽ������ʵļ���ʱ��Ҫ�������ʵ��������ʺ�������Ӧ��ѡ���ʵ����Լ��ͷ�����ȷ�۲췴Ӧ�е�������������ɫ�ı仯�����������ɺ��ܽ⡢����IJ�������ζ���������ɫ�ȣ������жϡ���������֤���ɣ�
��


 �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ΪC7H16�������о��֣����н�����һ�ֵ�ϩ��������Ƶõ��У�������
| �� | A�� | 1�� | B�� | 2�� | C�� | 3�� | D�� | 4�� |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�мס����������ʣ�
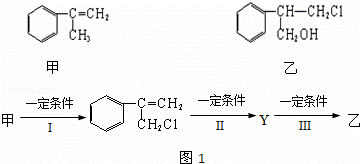
��1�����к��еĹ����ŵ�����Ϊ��������������������
��2���ɼ�ת��Ϊ���辭��ͼ1��ʾ�Ĺ��̣�����ȥ������Ӧ���ز����ͬ�������з�ӦI�ķ�Ӧ��������������Ӧ�����������������Ӧ��Ļ�ѧ����ʽΪ����������ע����Ӧ��������
��3���������ʲ������ҷ�Ӧ����������ѡ����ţ���a�������� b����ˮ c��̼������Һ d������
��4�����ж���ͬ���칹�壬��д����һ����ͬʱ��������������ͬ���칹��ṹ��ʽ������
a�������ϵ�һ�ȴ��������� b����FeCl3��Һ��ʾ��ɫ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�г���H+��OH�����⣬�����д�����Mg2+��Fe3+��Cl���������������ӵ����ʵ���Ũ��֮��Ϊ1��1��6�������йظ���Һ�ж���ȷ���ǣ�������
�� A�� �����Һ�м���KI��Һ��ԭ�е�5�����ӵ����ʵ�������
�� B�� �����Һ�еμ�ϡNaOH��Һ���������ְ�ɫ����
�� C�� �����Һ�м���������ۣ�ֻ�����û���Ӧ
�� D�� ����Һ��c ��Cl����=0.6mol/L�������Һ��pH=1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ҵ��ˮ�п��ܺ������¼����������ӣ�
������ Fe3+��Al3+��Fe2+��Ba2+��Na+
������ Cl����CO32����NO3����SO42����SiO32��
�ֶԸ÷�ˮ��Ʒ���������о���
�����Թ��еμ�Ũ���ᣬ����������ɫ�������ɣ�����������������Ϊ����ɫ��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�
����������õ���Һ�м��������NaOH��Һ���к��ɫ�������ɣ����˺���������Һ��ͨ�������CO2���壬�а�ɫ��״�������ɣ�
��������ʵ�飬�ش��������⣺
��1���÷�ˮ��һ�����е���������������һ�������е�������������
д�����������Һ��ͨ�������CO2�������ɰ�ɫ��״���������ӷ���ʽ��ֻд��һ����������
��3����֪�����ۿ��Գ�ȥ��ˮ�е�һ�������ӣ�X������������Һ��pHΪ10.7���ң��ټ������ۣ���ȥX���ӵ�ͬʱ���������͵������������Ϊ1�s4��������з�Ӧ�����ӷ���ʽ����ƽ����X�þ�������ӷ��ű�ʾ��
����Al+����X+��7��OH��=����AlO2��+����NH3+����N2+��2H2O�����÷�Ӧ�Ļ�ԭ��������������ȥ0.2molX���ӣ�Ҫ����������g��
��4��������ˮ�е���Ԫ����ȫת����Fe3+����ʱ���c��Fe3+��=1.0��10��2mol•L��1��Ҫ�뽫��ת��ΪFe��OH��3��������ȥ����Ӧ������ҺpH���ٴ�������������֪������Fe��OH��3��Ksp=1.0��10��38��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��ҵ�ھ��÷�չ�е����þ������أ������йع�ҵ�����������У���ȷ���ǣ���
A�� ���������г����ø�ѹ�������SO2��ת����
B�� �ϳɰ��в��ü�ʱ���백����߷�Ӧ����
C�� ��⾫��ͭʱ����Һ��c��Cu2+���������ֲ���
D�� �ȼҵ��ⱥ��ʳ��ˮʱ�������õ��������ƺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������ֳư�������أ��ŵ�ʱ���ܷ�ӦΪ��Fe+Ni2O3+3H2O=Fe��OH��2+2Ni��OH��2�������йظõ�ص�˵������ȷ���ǣ���
A�� ��صĵ��ҺΪ������Һ������ΪNi2O3������ΪFe
B�� ��طŵ�ʱ��������ӦΪFe+2OH﹣﹣2e﹣=Fe��OH��2
C�� ��س������У�����������Һ��pH����
D�� ��س��ʱ��������ӦΪ2Ni��OH��2+2OH﹣﹣2e﹣=Ni2O3+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҩ�ǰѲݵijɷ�֮һM��������ɱ�����ã�M�Ľṹ������ʾ��HOHOOO
����������ȷ����(����)
A��M����Է���������180
B��1 mol M�������2 mol Br2������Ӧ
C��M��������NaOH��Һ������Ӧʱ�������л�����Ļ�ѧʽΪC9H4O5Na4
D��1 mol M������NaHCO3��Ӧ������2 mol CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ڱ�״���£�����������ռ���������( )
A��98 g H2SO4 B��56 g Fe C��44.8 L HCl D��6 g H2
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com