
| A、Fe、Mg |
| B、Zn、Al |
| C、Zn、Ag |
| D、Cu、Al |
| 35.5g |
| 35.5g/mol |
| 20g |
| 0.5mol |
| 1mol |
| 2 |
| 20g |
| 0.5mol |
| 56 |
| 3 |
| 112 |
| 3 |
| 27 |
| 3 |
| 27 |
| 3 |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
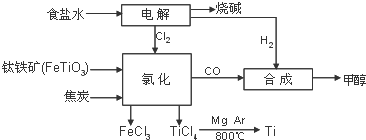 某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染.流程如图:
某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染.流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| ① |
| NaOH/乙醇 |
| ② |
| 一定条件 |
| ③ |
| 一定条件 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 在滴有酚酞的Na2CO3溶液中, 加入BaCl2溶液后红色褪去 | 验证Na2CO3溶液中存在水解平衡 |
| B | 在未知溶液中加入稀盐酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 用玻璃棒蘸取氯水点在pH是指中央 | 检验氯水呈酸性 |
| D | 将C与浓硫酸反应后的气体直接通入石灰水 | 证明反应有CO2生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHA的电离方程式:═Na++H++A2- |
| B、HA-的水解方程式:HA-+H2O?H3O++A2- |
| C、该溶液中离子的物质的量浓度关系:c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-) |
| D、该溶液中离子的物质的量浓度关系:c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com