
| A. | 保存在棕色瓶中 | B. | 不易挥发 | C. | 与铜不反应 | D. | 受热不分解 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
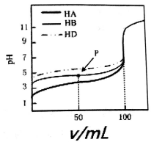
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸H2C═CHCOOH | B. | 乳酸CH3CH(OH)COOH | ||
| C. | 甘氨酸NH2CH2COOH | D. | 丙酸CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56 L | B. | 1.344 L | C. | 2.016 L | D. | 2.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
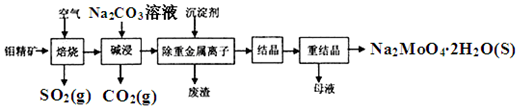
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
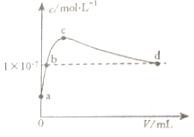
| A. | b点溶液呈中性 | |
| B. | d点溶液中:c(K+)=2c(CO32-)+c(HCO3-) | |
| C. | c点溶液中:2c(H2CO3)+c(H+)+c(HCO3-)=c(OH-) | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH升高的主要原因:Mg+2H+═Mg2++H2↑ | |
| B. | 生成沉淀a的离子方程式:Ag++Cl-═AgCl↓ | |
| C. | 沉淀b是Mg(OH)2 | |
| D. | 若a、b的物质的量关系为n(a):n(b)=1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com