
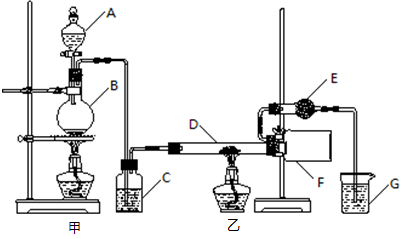


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
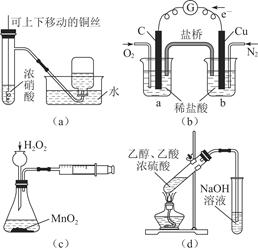
| A.用(a)装置制备并收集少量NO2气体 |
| B.通过(b)装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O |
| C.装置(c)可用于定量测定H2O2的分解速率 |
| D.装置(d)可用于实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
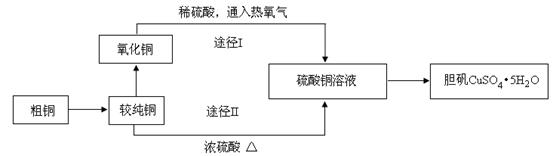
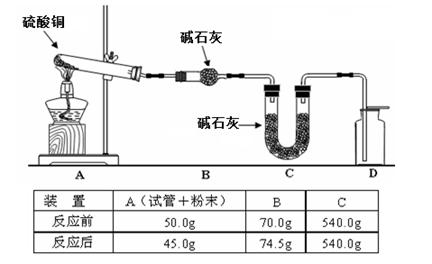
查看答案和解析>>
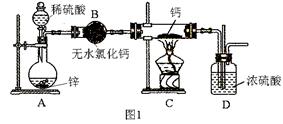
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
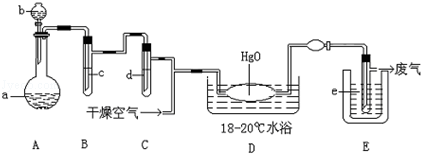
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
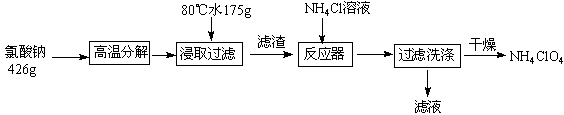
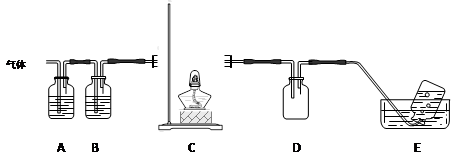
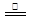 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
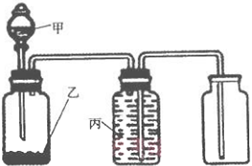
| 选项 | 甲 | 乙 | 丙 | 实验目的 |
| A | 浓氨水 | NaOH | 饱和食盐水 | 制取并收集氨气 |
| B | 浓盐酸 | MnO2 | 饱和食盐水 | 制取并收集氯气 |
| C | 稀硝酸 | Cu | 水 | 制取并收集一氧化氮 |
| D | 稀硝酸 | Zn | 水 | 制取并收集氢气 |
查看答案和解析>>
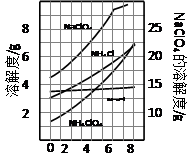
科目:高中化学 来源:不详 题型:实验题
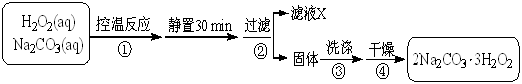
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com