
 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题:
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题: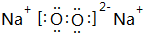 ;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.分析 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂,则X为H元素、Y为O元素;X、Y、Z最外层电子数之和为8,Z原子最外层电子数为8-1-6=1,则Z为Na;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1,该气态化合物的摩尔质量为22.4L/mol×2.86g•L-1=64g/mol,则M为S元素,Q只能为Cl.
解答 解:X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂,则X为H元素、Y为O元素;X、Y、Z最外层电子数之和为8,Z原子最外层电子数为8-1-6=1,则Z为Na;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1,该气态化合物的摩尔质量为22.4L/mol×2.86g•L-1=64g/mol,则M为S元素,Q只能为Cl.
(1)所有元素中H原子半径最小,同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:H<O<Cl<S<Na,故答案为:H<O<Cl<S<Na;
(2)Q为Cl元素,在周期表中位置:第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(3)H、O、Cl三种元素形成的三原子分子结构式为H-O-Cl;非金属性S<Cl,故两元素形成的最高价氧化物对应的水化物中强的酸是HClO4,故答案为:H-O-Cl;HClO4;
(4)O与Na形成的化合物A既含离子键又含共价键,A为Na2O2,电子式为 ,将Na2O2加入盛有酚酞试液的试管中观察到的现象为:有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
,将Na2O2加入盛有酚酞试液的试管中观察到的现象为:有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为: ;有大量气泡生成,溶液先变红后褪色;2Na2O2+2H2O=4NaOH+O2↑;
;有大量气泡生成,溶液先变红后褪色;2Na2O2+2H2O=4NaOH+O2↑;
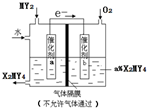
(5)利用如图装置可将化合物SO2转化为重要化工原料H2SO4,由电子移动方向可知,催化剂a极为负极,发生氧化反应,a表面发生的电极反应方程式为:SO2+2H2O-2e-═SO42-+4H+,根据电子转移守恒,理论上通入SO2与O2的物质的量最佳比值为2:1,
故答案为:SO2+2H2O-2e-═SO42-+4H+;2:1.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,熟练掌握元素化合物组成与性质,(5)中注意电子流向判断电极.


科目:高中化学 来源: 题型:选择题
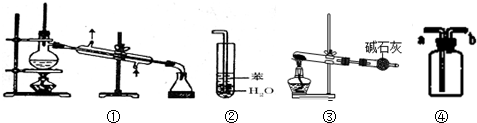
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,防止倒吸 | |
| C. | 以KClO3 为原料,装置③可用于制备少量O2 | |
| D. | 装置④a进口可收集H2、CO 等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3O2分子、COS分子中碳原子可能都采取sp杂化 | |
| B. | C3O2和CO2都是碳的氧化物,它们互为同分异构体 | |
| C. | COS是由极性键构成的非极性分子,分子中所有原子都满足8电子稳定结构 | |
| D. | COS在氧气中完全燃烧,生成物是CO2和SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性强弱顺序为R>W>Y | |
| B. | R与其他三种元素均能形成共价化化物 | |
| C. | 简单氢化物的热稳定性强弱顺序为R>Y>W | |
| D. | 原子半径大小顺序为r(W)>r(R)>r(X)>r(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com