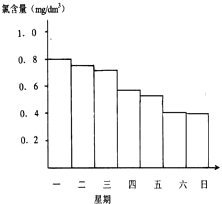
游泳池水的含氯量应该控制在0.5mg/L至1.0mg/L之间,
(1)写出氯气溶于水的方程式
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.溶于水中的哪种物质可杀菌消毒
HClO
HClO
.
(2)如图显示一星期中每天19时泳池中水的氯含量,哪几天使用泳池不安全
星期六、星期日
星期六、星期日
.
(3)你认为哪几天的天气炎热、阳光强烈
星期四到星期六
星期四到星期六
,说出一种理由是
天气炎热、日光强烈水温升高,次氯酸在强光照射下分解加快,故氯的含量降低较大
天气炎热、日光强烈水温升高,次氯酸在强光照射下分解加快,故氯的含量降低较大
.
(4)若把一片紫色的花瓣放入氯水中,可观察到现象
紫色花瓣先变红,后褪色
紫色花瓣先变红,后褪色
.
(5)若游泳池蓄水1200000L,要使星期日的氯含量回复到0.8mg/L,需加入
480
480
g的氯气,需要加入
162.2
162.2
L的氯气(在常压和室温下测量).
(6)小型泳池通常使用次氯酸钠溶液而非氯气来消毒池水,试举出使用次氯酸钠溶液而非氯气的一项理由
次氯酸钠溶液比较稳定,容易储运
次氯酸钠溶液比较稳定,容易储运
.用化学方程式说明工业上如何生产次氯酸钠溶液
Cl2+2NaOH=NaClO+NaCl+H2O
Cl2+2NaOH=NaClO+NaCl+H2O
.(在常压和室温下,气体摩尔体积为24.0L/mol).

 游泳池水的含氯量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯量应该控制在0.5mg/L至1.0mg/L之间,
