
【题目】碘海醇是一种非离子型X-CT造影剂。下面是以化合物A(分子式为C8H10的苯的同系物)为原料合成碘海醇的合成路线[R为-CH2CH(OH)CH2OH]:
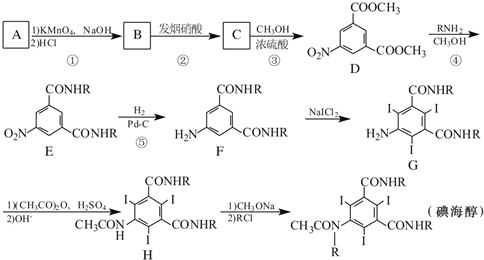
(1)写出A的结构简式:____________。
(2)反应①-⑤中,属于取代反应的是____________(填序号).
(3)写出C中含氧官能团的名称:硝基、____________。
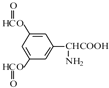
(4)写出同时满足下列条件的D的两种同分异构体的结构简式:____________。
Ⅰ.含1个手性碳原子的α-氨基酸
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应
(5)已知:①![]()
②![]() 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以![]() 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体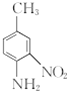 的合成路线流程图(无机试剂任用)____________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)____________________。合成路线流程图示例如下:![]() 。
。
【答案】![]() ②③④ 羧基
②③④ 羧基 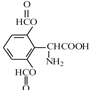 、;
、;
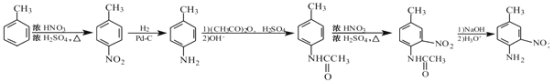
【解析】
(1)由C与甲醇发生酯化反应生成D,根据D的结构简式,则C为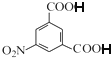 ,B发生消化反应生成C,所以B为
,B发生消化反应生成C,所以B为 ,A被高锰酸钾氧化生成B,又化合物A(分子式为C8H10的苯的同系物),所以A的结构简式为:
,A被高锰酸钾氧化生成B,又化合物A(分子式为C8H10的苯的同系物),所以A的结构简式为:![]() ,故答案为
,故答案为![]() ;
;
(2)根据(1)的分析反应①为氧化,②为消化属于取代,③是酯化属于取代,④为D中的-OCH3被-NHR取代,⑤与氢气发生还原反应,故答案为②③④;
(3)根据(1)的分析,C为 ,含氧官能团的名称:硝基、羧基,故答案为羧基;
,含氧官能团的名称:硝基、羧基,故答案为羧基;
(4)Ⅰ含1个手性碳原子的α-氨基酸,则含有-CH(NH2)COOH基团;Ⅱ苯环上有3个取代基,分子中有6种不同化学环境的氢,说明一般为对称结构;Ⅲ能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应,说明含有酚酯,则符合条件的D的两种同分异构体的结构简式为 、
、 ,故答案为
,故答案为 、
、 ;
;
(5)由![]() 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体![]() ,则先要引入对位硝基,再还原成氨基,但由于
,则先要引入对位硝基,再还原成氨基,但由于![]() 呈弱碱性,易被氧化,所以引入间位硝基时要将氨基保护起来,等间位硝基引入,在将氨基还原,所以流程为:
呈弱碱性,易被氧化,所以引入间位硝基时要将氨基保护起来,等间位硝基引入,在将氨基还原,所以流程为: .故答案为
.故答案为 。
。
【点晴】
本题为有机框图、信息推断题,解这类题目的关键是看懂信息,明确各类有机物的基本反应类型和相互转化关系,题目难度中等。该类题综合性强,思维容量大,常以框图题或变相框图题的形式出现,解决这类题的关键是以反应类型为突破口,以物质类别判断为核心进行思考。经常在一系列推导关系中有部分物质已知,这些已知物往往成为思维“分散”的联结点。可以由原料结合反应条件正向推导产物,也可以从产物结合条件逆向推导原料,也可以从中间产物出发向两侧推导,审题时要抓住基础知识,结合新信息进行分析、联想、对照、迁移应用、参照反应条件推出结论。解题的关键是要熟悉烃的各种衍生物间的转化关系,不仅要注意物质官能团的衍变,还要注意同时伴随的分子中碳、氢、氧、卤素原子数目以及有机物相对分子质量的衍变关系。


科目:高中化学 来源: 题型:
【题目】2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
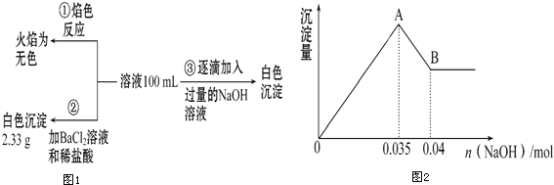
请根据上图回答下列问题:
①实验中需配制1.0molL﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________.
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________.
③试确定NO3-是否存在?________(填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____(若不存在,此问不必作答).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快该反应速率,不能采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度 C.扩大容器的体积 D.适当降低反应的温度
(2)该反应属于______反应(填“吸热”和“放热”)。
下图能正确表示该反应中能量变化的是________。

(3)氢氧燃料电池如图所示:
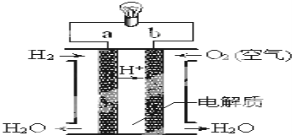
①a为________(填“正极”或“负极”),b电极发生_____反应(填“氧化”或“还原”);
②外电路中电子从b电极___,(填“流入”或“流出”),内电路中阳离子移向____极 (填”a”或”b”);
③写出该装置中正极上的电极反应式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:(废料中的其他金属含量较低,对实验影响可忽略)
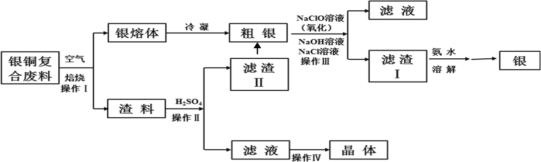
已知:①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×105,Ksp(AgCl)=1.8×1010;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取_______措施(写出其中一种即可)。
(2)操作IV经过________、_______过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是__________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为______(其中AgCl和NaCl的物质的量之比为2∶1)。氧化的同时发生沉淀转化,离子方程式为_____,其平衡常数K=__________。
(5)在空气中加热5.20g硫酸铜晶体(CuSO4·5H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。(已知CuSO4·5H2O相对分子质量250)
温度范围/℃ | 固体质量/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
加热到1000℃时,固体物质的化学式为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘的废液(除H2O外,含有CCl4、I2、I 等)中回收碘,其实验过程如下,下列各项操作选用的装置不正确的是( )
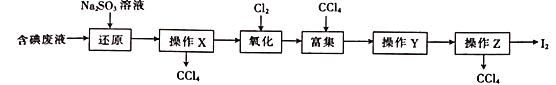
选项 | A | B | C | D |
操作 | 操作X | 氧化 | 操作Y | 操作Z(加热及夹持装置略去) |
装置 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、氯化亚铜(CuCl)难溶于水,常用作催化剂、气体吸收剂及脱氯剂等。
(1)向一定比例的CuSO4、NaCl溶液中持续加入一定浓度的Na2SO3溶液可制得CuCl。加入的Na2SO3溶液体积与溶液pH关系如图所示。
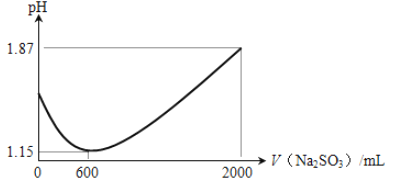
① 0 ~ 600 mL时pH降低的原因是_______(用离子方程式表示);
② 600 ~ 2000 mL的过程中有刺激性气味的气体产生,该气体是__________。
(2)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 molL-1的CuCl2溶液中加入足量的铜,写出计算过程说明能否生成CuCl: ________。
(3)使用CuCl捕捉CO气体的反应为CuCl(s) + xCO(g) ![]() CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuClxCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A.降低温度 B.增大压强
C.延长反应时间 D.把CuCl分散到疏松多孔的分子筛中
Ⅱ、钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
上述盐溶液中的阴离子,结合氢离子能力最强的是__________ ;根据表中数据,下列三种酸的溶液分别稀释100倍,pH变化最大的是(填序号)___________
A. HClO B.H2CO3 C. CH3COOH
(2)次氯酸钠是一种 ______(填“强”或“弱”)电解质。某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是______(请用反应的离子方程式表示)。
(3)实验室中常用氢氧化钠来进行洗气和提纯。
当150mL 1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com