
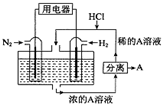
 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
分析 以N2、H2为原料,以溶有A的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,电流从正极流向负极,以此解答该题.
解答 解:A.电流从正极流向负极,即电流从通入N2的电流流向通入H2的电极,故A错误;
B.放电过程中,负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,消耗氢离子,电解质溶液PH升高,故需要加入盐酸,故B正确;
C.正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故C正确;
D.根据负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,则H2为负极,A为NH4Cl,故D正确.
故选A.
点评 本题考新型燃料电池,侧重于学生的分析能力的考查,注意根据总反应式判断出正负极的反应,从化合价变化的角度分析,难度不大.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性的共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
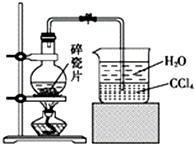 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn和浓H2SO4 | B. | C和浓HNO3 | ||
| C. | Cu和浓HNO3 | D. | Na2O2和NH4Cl浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
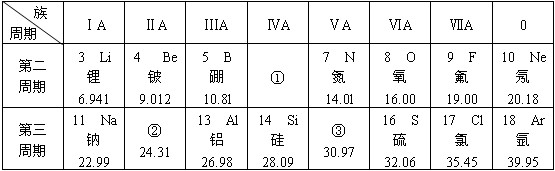
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com