
| c(H+) |
| c(OH-) |
| 0.01mol |
| 30×10-3L |
| 1 |
| 3 |
| 0.01mol |
| 30×10-3L |
| 1 |
| 3 |
| Ksp |
| c(A2-) |
| 1.8×10-10 | ||
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2 |
| B、将KIO3溶液滴入含有淀粉的酸性KI溶液中,溶液变蓝:5I-+IO3-+3H2O═3I2+6OH- |
| C、硅酸钠溶液与醋酸溶液混合,产生白色沉淀:SiO32 -+2H+═H2SiO3↓ |
| D、向NaAlO2溶液中通入过量CO2,产生白色沉淀:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
B、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| C、漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | ||||
| D、明矾溶液与氢氧化钡溶液反应,使 SO2-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
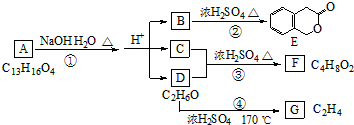
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若甲试管溶液呈蓝色,则乙试管溶液一定呈血红色 |
| B、若甲试管溶液呈蓝色,则乙试管溶液可能无明显现象 |
| C、乙试管溶液呈血红色,则甲试管溶液不可能呈蓝色 |
| D、甲试管溶液呈蓝色,丙试管中紫红色褪去,说明滴加氯水后的溶液中一定存在Fe3+和Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
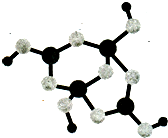 运用物质结构的知识完成B、N元素的问题.
运用物质结构的知识完成B、N元素的问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质 物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量a kJ |
| ② | 0 | 1 | 3 | 放出热量b kJ |
| ③ | 4 | 0 | 0 | 吸收热量c kJ |
| A、热量关系:a=b |
| B、①②③反应的平衡常数:③>①>② |
| C、达平衡时H2的体积分数:①>③ |
| D、①中的密度不再改变时说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com