
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基-4 -乙基戊烷B. 3, 4, 4 -三甲基己烷
C. 2, 3 -二乙基-1 -戊烯D. 1, 2, 4 -三甲基-1 -丁醇
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____种不同运动状态的电子,有_____种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______晶体,试比较组成该物质的两微粒半径大小____________________。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO![]() 3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________,
滴入少量盐酸,上述体系中Al3+浓度_______(填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________极可得金属铝的质量为__________克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/ LNaOH溶液滴定25.00mL0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示。下列说法正确的是
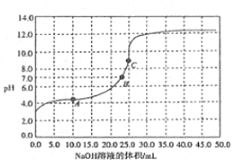
A. HX为强酸
B. 在A点,c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点.c(X-)+ c(HX)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二甲醚和乙醇是同分异构体,下列鉴别二者的方法中不可行的是( )
A. 利用金属钠B. 利用红外光谱法
C. 利用核磁共振氢谱D. 利用质谱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
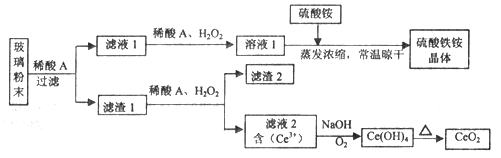
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com