
【题目】植物种子本身是非常好的实验材料,回答下面相关问题:
I.蓖麻种子的胚乳呈白色,脂肪含量为种子的70%。为探究该植物种子萌发过程中的物质变化,某研究小组将种子置于温度、水分(蒸馏水)、通气等条件适宜的黑暗环境中培养,定期检查萌发种子(含幼苗)的脂肪、蔗糖、葡萄糖的含量和干重,结果如图所示。回答下列问题:

(1)据甲图分析,萌发过程中胚乳组织中的脂肪酶催化脂肪水解成甘油、脂肪酸,并转变为______________作为胚生长和呼吸消耗的原料。
(2)蓖麻种子中脂肪含量较高,脂肪是脂质的一种,除此外,常见的脂质还有_____和固醇,其中固醇类物质包括胆固醇、_______、_______。胆固醇的作用是_______________。
(3)据乙图可知,蓖麻种子萌发初期时干重增加,导致萌发种子干种增加的主要元素是___________。 第7天至第10天萌发种子(含幼苗)的干重变化趋势是__________,原因是幼苗不能进行光合作用,呼吸作用消耗有机物超过脂肪转化增加的有机物。
II. 大豆种子萌发过程,干重和鲜重均发生变化,鲜重的变化曲线如图,图中阶段______种子胚细胞中自由水的含量最多。
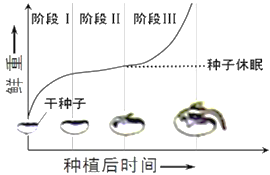
【答案】糖类(葡萄糖、蔗糖) 磷脂 性激素 维生素D 构成动物细胞膜的重要成分,在人体内参与血液中脂质的运输 O 下降 III
【解析】
由图可知,蓖麻种子萌发时,脂肪含量降低,糖的含量逐渐升高。种子萌发初期要大量吸水进行物质的水解,水解后的产物中含有了参与反应的水中的元素,使干重增加。
I.(1)由图甲可知,蓖麻种子萌发时,脂肪含量逐渐降低,糖的含量逐渐升高,说明萌发过程中胚乳组织中的脂肪酶催化脂肪水解成甘油、脂肪酸,并转变为糖类(葡萄糖、蔗糖)作为胚生长和呼吸消耗的原料。
(2)脂质包括脂肪、磷脂和固醇,其中固醇类物质包括胆固醇、性激素和维生素D。胆固醇是构成动物细胞膜的重要成分,在人体内还参与血液中脂质的运输。
(3)种子萌发初期,蓖麻种子中的脂肪大量水解,一部分水参与形成了水解产物,使干重有所增加,故导致萌发种子干种增加的主要元素是O。由图乙可知,第7天至第10天萌发种子(含幼苗)的干重降低。
II.种子萌发过程中,鲜重增加的原因主要是由于吸水,干种子时期,细胞中自由水含量较少,随着萌发过程的吸水,自由水含量增加,阶段III鲜重增加较快,说明吸收了较多的水,自由水较多。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是
A. 60mL B. 45mL
C. 30mL D. 15mL
【答案】C
【解析】
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与0.84L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
NO2、N2O4、NO混合气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)0.0325mol×2=0.075mol,根据Cu原子个数守恒可知Cu(NO3)2为0.075mol;根据 Cu2+—2OH—得NaOH 为 0.075mol×2=0.15 mol,则NaOH,溶液的体积V为0.15 mol/5mol/L=30mL,故选C。
【点睛】
本题主要考查了金属与硝酸反应的计算,根据氧化还原反应中电子得失守恒和原子个数守恒计算是解答的关键。
【题型】单选题
【结束】
26
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中分子式所代表的物质一定互为同系物的是
A. C2H6O与C3H8O B. C6H6O与C7H8O(均含苯环)
C. C4H8与C3H6 D. C7H8与C8H10(均含苯环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________。

(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ·mol-1。若已知下列数据:
化学键 | HH |
|
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1 ②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和O2。下列说法中正确的是

A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,电极Y与外接直流电源的负极相连
C. 该电池放电时,每转移4 mol电子,理论上生成1mol C
D. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com