
| ���� | ���� | ���� | |
| �۵㣨�棩 | -183.3 | -189.7 | -138.4 |
| �е㣨�棩 | -88.6 | -42.1 | -0.5 |
���� ������������ȼ�շ���ʽ���Կ�����ȼ����ͬ�������Ȼ�����ĵĿ�������ϴ����Ҫ��֤��Ȼ����ȫȼ�գ��ͱ���Ӵ�������������������ڣ�������ı�ͻ������Ȼ�����ܳ��ȼ�ն���������CO������ʹ���ж����������ӱ������ݿ��Կ���������ķе�Ϊ-0.5�棬�ڶ����¶Ƚϵ�ʱ����Һ��ΪҺ�壬ʹ�ܵ���������������˻����С��
��� �⣺������������ȼ�շ���ʽ���Կ�����Ŀǰ��ʡ���ٳ��о�����ʹ�õ�ȼ����Ҫ�ǹܵ�ú�����еĵط��Ѿ���ʼʹ����Ȼ����Ϊ����ȼ�ϣ��ܵ�ú������Ҫ�ɷ���CO��H2���������࣬��Ȼ������Ҫ�ɷ���CH4�����ǵ�ȼ�շ�Ӧ���£�
2CO+O2$\stackrel{��ȼ}{��}$2CO2 2H2+O2$\stackrel{��ȼ}{��}$2H2O CH4+2O2$\stackrel{��ȼ}{��}$CO2+2H2O
ȼ����ͬ�������Ȼ�����ĵĿ�������ϴ����Ҫ��֤��Ȼ����ȫȼ�գ�ȼ�չܵ�ú������߸�����Ȼ�����ͱ���Ӵ�������������������ڣ�������ı�ͻ������Ȼ�����ܳ��ȼ�ն���������CO������ʹ���ж����������ӱ������ݿ��Կ���������ķе�Ϊ-0.5�棬�ڶ����¶Ƚϵ�ʱ����Һ��ΪҺ�壬ʹ�ܵ���������������˻����С���ҳʶ���״̬��
�ʴ�Ϊ����Ȼ����������Ȼ�����ܳ��ȼ�գ����������ж���CO��������������ΪҺ��ʹ�ܵ�������������
���� ���⿼���˻�ѧ��Ӧ�����仯�ķ�������Ҫ�Ƿ�Ӧ��������ķ����жϣ�����Ϣ�ķ���Ӧ�ã����ջ�����������ϸ�ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 | B�� | 3 | C�� | 4 | D�� | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a g | B�� | 0.5a g | C�� | 4.4a g | D�� | 1.8a g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2+2H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+Mn2++H2O | |
| B�� | ����ʯ��ˮ�������մ���Һ��ϣ�Ca2++OH-+HCO3-�TCaCO3��+H2O | |
| C�� | ̼������ڴ��CaCO3+2H+�TCa2++CO2��+H2O | |
| D�� | �Ȼ�������Һ��ͨ��������2Fe2++Cl2�T2Fe3++2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ijѧ����pH��ֽ��������ˮ��pHֵ���ȱ�����ɫ������ΪCl2��ǿ������ | |
| B�� | ����ƿ����Һ©�����ζ�����ʹ��ǰҪ����Ƿ�©ˮ | |
| C�� | Ϊ�ⶨ�����������Ƶĵ����ԣ����ڴ��������ۻ��������ƹ������в��� | |
| D�� | ��ͭƬ����Ũ�����У�������ʵ������˵��ͭ�����Ũ�����з����ۻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 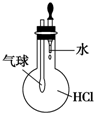 ��֤HCl���ܽ��� | B�� | 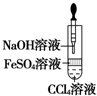 �Ʊ�Fe��OH��2 | ||
| C�� | 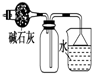 ���ﲢ�ռ�NH3 | D�� | 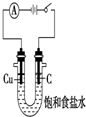 ���õ�ⷨ��H2��Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | ����/��kJ•mol-1�� | ��ѧ�� | ����/��kJ•mol-1�� |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A�� | ������ȼ����Ϊ��H=-483kJ/mol | |
| B�� | H2��g��+I2��g��$\frac{200��}{\;}$2HI��g����H=-5kJ/mol | |
| C�� | N2��g��+3H2��g��?2NH3��g����H=-92kJ/mol | |
| D�� | ����ͬ�����£�������������ȫȼ�պ����������ȼ�յ��ʱ���ʱ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com